パイロトーシスとアポトーシスの違いとは?
著者:Mehak Passi(ルートヴィヒ・マクシミリアン大学ミュンヘン博士課程研究員)
パイロトーシス(Pyroptosis)とは?
パイロトーシス(Pyroptosis)とは、炎症反応に伴う細胞溶解の一種です。パイロトーシスは、制御性ネクローシス(regulated necrosis)とも呼ばれ、特定の条件が揃うことで炎症性カスパーゼ(カスパーゼ1、カスパーゼ5)によって媒介されます。パイロトーシスは、細胞膜を介したイオン濃度勾配の破綻と浸透圧の上昇を特徴とし、細胞膜の崩壊と細胞内容物の周囲への放出を生じます。
パイロトーシスは、カノニカル(古典的)経路(canonical pathway)およびノンカノニカル(非古典的)経路(non-canonical pathway)の2通りのメカニズムによって発生します。古典的経路では、シグナル認識に関連するパターン認識受容体(NLRP1、NLRP3、NLRC4、AIM2等)がセンサーとなり、外因性の微生物由来のシグナルが感知され、「インフラマソーム(inflammasome:炎症反応を惹起するタンパク質複合体)」の形成と活性化が生じます。パターン認識受容体の活性化後、ASC(Apoptosis-associated speck-like protein containing a CARD)と呼ばれるアダプタータンパク質が動員されることで応答を開始し、ASCはさらにカスパーゼ1前駆体(pro-caspase 1)を動員してインフラマソームを形成します。インフラマソームが形成されると、カスパーゼ1前駆体が切断されて活性型カスパーゼ1になり、活性型カスパーゼ1はその基質であるGSDMD(Gasdermin D、ガスダーミンD)を切断します。切断によって生成されたGSDMDのN末端フラグメントは、イノシトールリン脂質等の特定のリン脂質に結合し、GSDMD‐N末端フラグメントの多量体となり、細胞膜に挿入されることで細孔(ポア、溶解孔)を形成します。またカスパーゼ1は、p33/p10やp20/p10フラグメントで構成される四量体を形成します。これらは、IL-18前駆体(pro-IL-18)やIL-1β前駆体(pro-IL-1β)を切断することによって成熟型IL-18やIL-1βへの変換を媒介し、細胞外マトリックスへ放出させ、炎症反応を引き起こします。
非古典的経路では、グラム陰性菌のLPS(Lipopolysaccharides、リポ多糖類)によってカスパーゼ4や5(ヒト)、カスパーゼ11(マウス)が活性化され、活性型カスパーゼがGSDMDを切断して細胞膜に細孔を形成します。GSDMDによって形成された細孔からカリウムが流出することで、二次的にNLRP3インフラマソームが活性化されることが知られており、IL-18前駆体(pro-IL-18)やIL-1β前駆体(pro-IL-1β)が切断され成熟型IL-18やIL-1βが生じます。細胞膜のGSDMD細孔は、パイロトーシスを引き起こす活性型サイトカイン等も放出します。
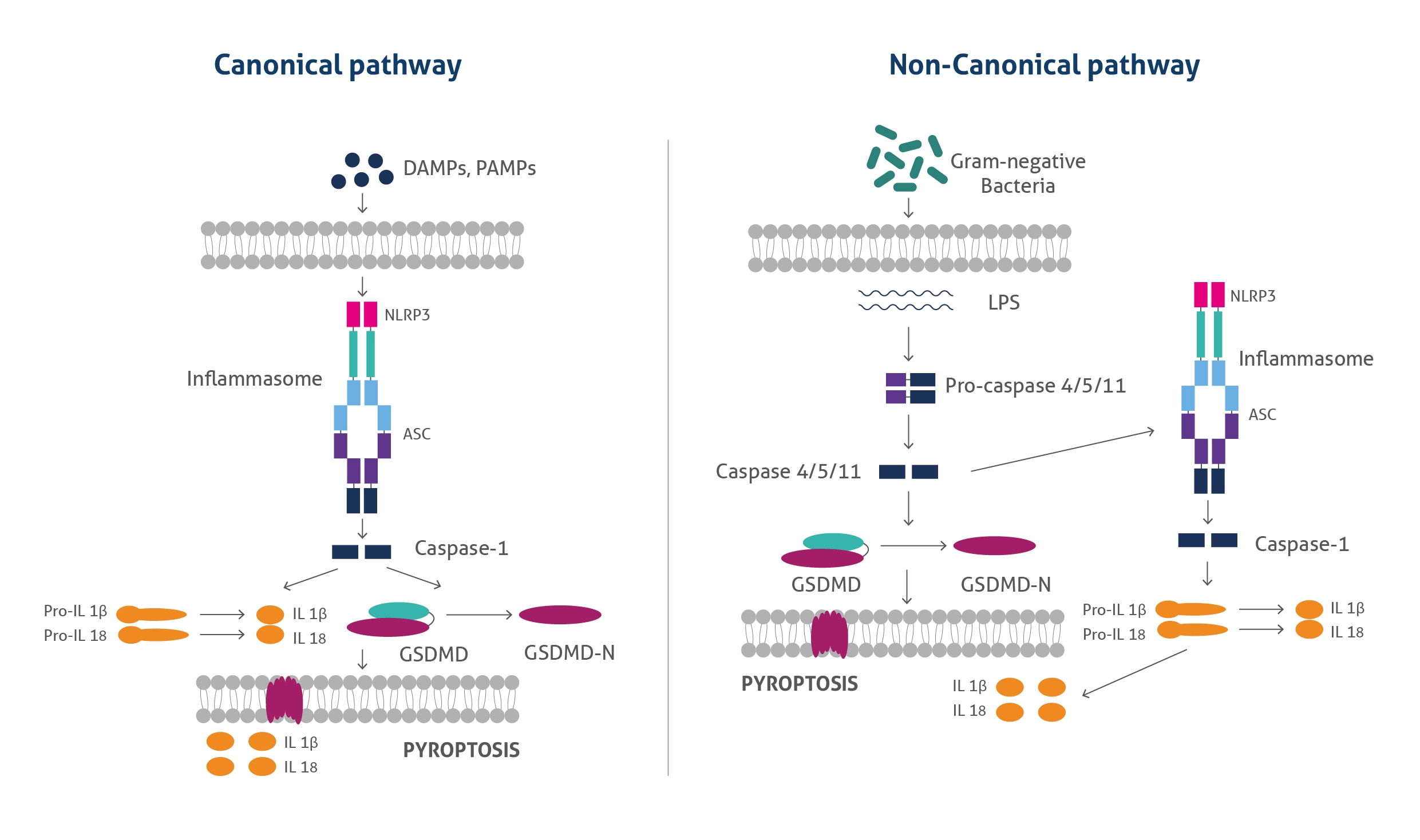
図1. カノニカル(古典的)経路およびノンカノニカル(非古典的)経路
 |
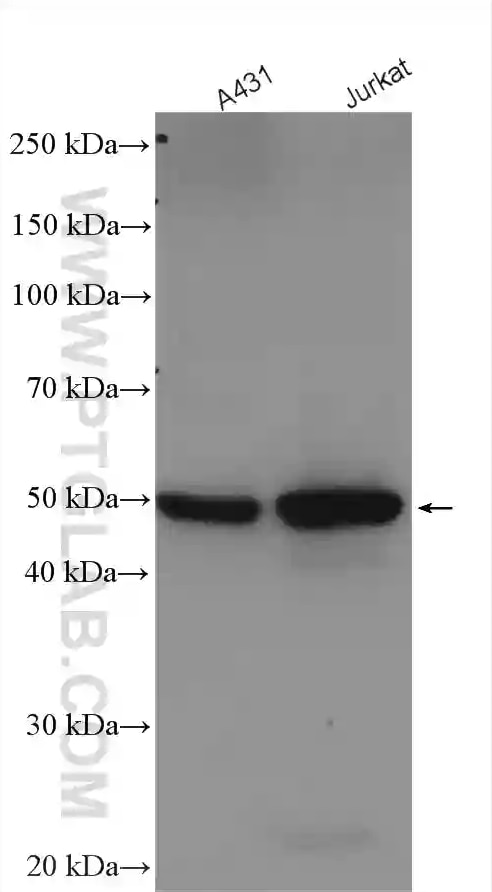 |
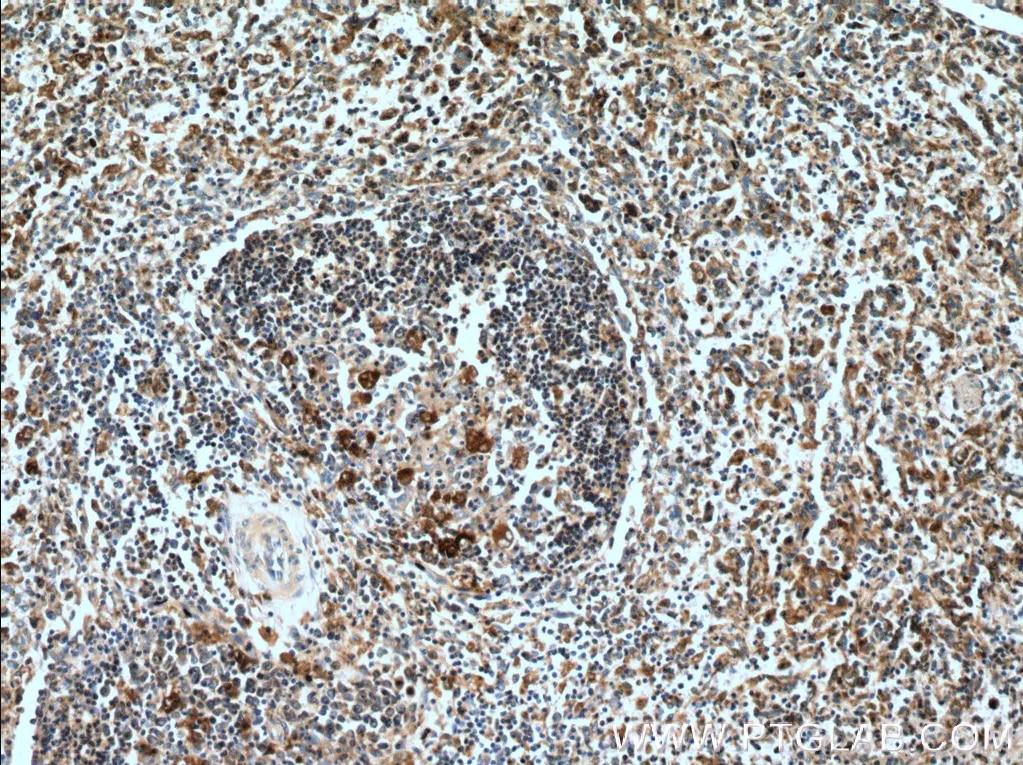
| カスパーゼ1ポリクローナル抗体(カタログ番号:22915-1-AP、希釈倍率1:200)を使用した、ヒト脾臓組織の免疫組織化学染色。 | GSDMDポリクローナル抗体(カタログ番号:20770-1-AP、希釈倍率1:5000)を使用した、様々なライセートのWB(ウェスタンブロット)。 |
パイロトーシスによる炎症の特徴
パイロトーシスに伴う継続的な炎症反応は、IL-1β、IL-18、HMGB-1等の炎症性メディエーターの濃度上昇を引き起こし、生体恒常性の維持機構を破綻させます。生体恒常性の維持機構は、腫瘍の進行、腫瘍免疫や免疫療法においても重要な役割を担います。例えば、GSDMDとは異なる経路であるGSDME(Gasdermin E、ガスダーミンE)媒介性のパイロトーシスは、HMGB1(High mobility group box 1 protein)の放出によるERK1/2経路の活性化を介して腫瘍細胞の増殖を促進することが報告されています。インフラマソームの出現は、カスパーゼ1、4、5、11活性化を引き起こし、肝炎、炎症性腸疾患、関節炎、肺炎、心筋炎、血管炎のような複数の疾病の病態形成に関与します。痛風性関節炎や変形性関節症では、BF-2(Baeckein E)やH2O2等の複数の分子がNLRP3インフラマソームを標的化して制御する分子となり得ることが判明しています。また、パイロトーシスは、GSDMD経路・カノニカル(古典的)経路を活性化することで、非アルコール性脂肪肝炎(NASH:non-alcoholic steatohepatitis)において重要な役割を担うことが示唆されています。
さらに、パイロトーシスは潰瘍性大腸炎(UC:ulcerative colitis)や腸炎関連性大腸がん(CAC:colitis-associated colon cancer、大腸炎関連発がん)と密接に関連しています。潰瘍性大腸炎(UC)では、パイロトーシスはIL-1β、IL-18、GSDMDのN末端フラグメント、NLRP3インフラマソーム、カスパーゼ1による炎症反応と関係しています。炎症反応プロセスは、Kuijieling(KJL)やデキストラン硫酸ナトリウム(DSS)等の分子によって阻害されます。腸炎関連性大腸がん(CAC)では、GSDMEの活性化によってパイロトーシスの開始とHMGB1の放出が引き起こされ、ERK1/2経路が活性化されることで腫瘍細胞の増殖が誘導および促進されます。一方、大腸がん細胞株においては、肝臓X受容体(LXR:liver X receptor)やロバプラチン(lobaplatin、抗がん剤)によるシグナル伝達を介したカスパーゼ1やGSDMEの活性化によって、パイロトーシスが誘導され、抗腫瘍効果を示すことが報告されています。
パイロトーシスは、炎症シグナルを増幅することで食道炎の発症を促進します。食道上皮細胞では、カスパーゼ1や炎症性サイトカイン(IL-1β、IL-18)が活性化し、パイロトーシスを生じます。また、パイロトーシスにおける重要な因子であるGSDMDの発現は、ERK(extracellular signal-regulated kinase)、STAT3(signal transducer and activator of transcription 3)、PI3K/AKT(phosphatidylinositol 3 kinase/protein kinase B)等の細胞周期に関連するシグナル伝達因子の発現との関連性も報告されており、生体を健全な状態に保つ働きにおいても重要な役割を担う可能性が示唆されています。
総じて、パイロトーシスは「諸刃の剣」のようなものと言われています。炎症作用による生体内の抗原排除機構の一部として働く一方で、臓器損傷の原因となる炎症性疾患の発症につながる可能性があります。がん治療研究との関連性においては、がん細胞のパイロトーシスを誘導することで、がん細胞の増殖を抑制できる可能性があります。
アポトーシス(Apoptosis)とは?
アポトーシスは、「プログラム細胞死(programmed cell death)」の代表的な形態であり、宿主ゲノムにコードされている特定のタンパク質によって媒介され、生体組織からの単一細胞の除去に働きます。アポトーシスは、細胞膜のブレブ形成(blebbing、ブレビング、小疱形成、水泡形成)と膜の摂動(perturbation)を特徴とします。それらの現象によって、断片化された細胞は、「アポトーシス小体(apoptotic body)」と呼ばれる小さな細胞膜結合小胞となり放出されます。アポトーシスは、「カスパーゼ(caspase)」と呼ばれる進化的に保存されたアスパラギン酸特異的システインプロテアーゼの多数に及ぶタンパク質ファミリーによって実行されます。通常、カスパーゼはその機能に応じて、イニシエーターカスパーゼ(initiator caspase、誘導型カスパーゼ)(カスパーゼ2、8、9、10)、エフェクターカスパーゼ(executioner caspase/effector caspase、実行型カスパーゼ)(カスパーゼ3、6、7)、および炎症性カスパーゼ(inflammatory caspase)(カスパーゼ1、4、5、11、12)の3種類のグループに分類されます。イニシエーターカスパーゼ(誘導型カスパーゼ)は、アポトーシスを開始する役割を担います。一方、エフェクターカスパーゼ(実行型カスパーゼ)は、最終的なアポトーシス性細胞死に誘導する大規模なタンパク質分解を実行します。炎症性カスパーゼは、パイロトーシスやサイトカイン性炎症反応に関与します。
アポトーシスが実行される際、活性型カスパーゼの集団的な作用によって細胞膜がかき乱され、細胞膜(リン脂質二重層)の細胞質側(細胞内側)が外側に露出します(リン脂質スクランブル)。これは、組織形成や組織再生が生じる胚形成時に必要とされる生理学的メカニズムです。多くの場合、アポトーシスは、組織の細胞増殖を維持するための恒常性維持機構であると言及されます。また、アポトーシスは、防御機構としても機能し、生体の免疫システムが感染症と戦うための極めて重要なプロセスです。その際、活性型T細胞やNK細胞によって産生されるグランザイムファミリー分子の一群によって、BID(BH3 interacting-domain death agonist)やカスパーゼが活性化されることで、アポトーシスが誘導されます。グランザイムによる機構とは別に、様々な病態生理学的条件や、特定の受容体分子(TNF、TRAIL、CD95)への刺激、熱ショック、紫外線暴露、細胞毒性を有する医薬品類、微生物感染、微生物由来の毒素、ウイルス感染、H2O2、セラミド処理等による刺激がアポトーシスを誘導します。放射線治療や化学療法に使用される医薬品への暴露によっても、p53依存性経路を介したアポトーシスが生じます。
一般的に、アポトーシスは「内因性経路(Intrinsic pathway)」と「外因性経路(Extrinsic pathway)」の2種類の主要な経路を介して開始します。内因性経路では、恒常性の不均衡、調節不全、DNA損傷等によって生じる、Bcl-2(B-cell lymphoma-2)ファミリータンパク質であるBAKやBAXの多量体化が引き金となります。BAK/BAX多量体は、ミトコンドリアの外膜に細孔を形成することでミトコンドリア外膜透過化(MOMP:outer mitochondrial membrane permeabilization)を引き起こし、シトクロムcを細胞質ゾルに放出します。シトクロムcが放出されることで、「アポトソーム(apoptosome:シトクロムc、Apaf-1、カスパーゼ9前駆体を含むタンパク質複合体)」が形成され、カスパーゼ9、カスパーゼ3の活性化が生じます。さらに、Bcl-2ファミリーに属するその他のアポトーシス促進タンパク質 (PUMA、BAD、BIK、NOXA)が活性化され、カスパーゼが様々なタンパク質を切断するアポトーシスカスケードが開始します。
外因性経路は、TNF受容体やTRAIL受容体(DR)のような細胞膜の表面にある受容体(デスレセプター、death receptor)が活性化することでシグナル伝達を開始します。受容体が多量体化(オリゴマー化)することによって、細胞表面でプラットホームが形成され、アダプタータンパク質であるTRADD(TNFR1-associated death domain)やFADD(Fas-associated death domain)、RIPK1(receptor-interacting protein kinase 1)を動員します。アダプタータンパク質を介してカスパーゼの前駆体が会合することでDISC(death-inducing signaling complex、細胞死誘導性シグナル伝達複合体)が形成され、カスパーゼ8やカスパーゼ10を活性化し、アポトーシスが引き起こされます。一方、アポトーシス阻害タンパク質として知られるカスパーゼ様タンパク質のFLIP(FLICE-like inhibitory protein)は、DISCにおいてカスパーゼ8やカスパーゼ10の活性を調節することで、細胞の生存と細胞増殖を促進し、炎症性サイトカインの産生を調節します。さらに、アポトーシス阻害因子によるRIPK1のユビキチン化も、外因性アポトーシス経路を調節します。これらの均衡が崩れると、エフェクターカスパーゼの活性化につながり、プログラム細胞死を開始する引き金となります。アポトーシスに至った細胞は、抗炎症性代謝物質を放出し、受容体が脱落し、DNAはクロマチン体やヌクレオソーム単位に断片化されます。ホスファチジルセリンや特定の分子は、細胞膜外部に露出することで食細胞の認識リガンドとなって食細胞を誘引します。
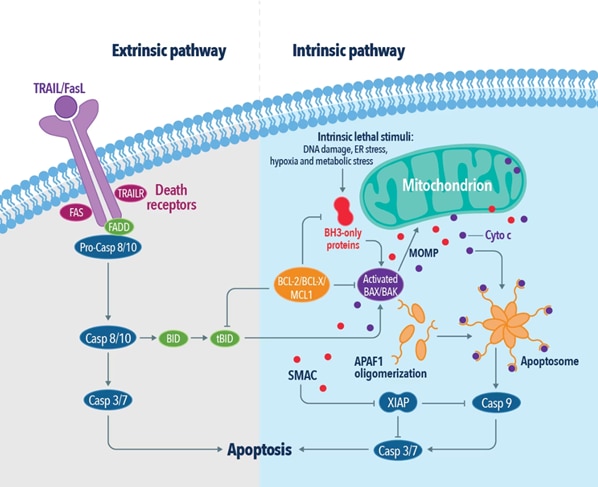
図2. 外因性アポトーシス経路および内因性アポトーシス経路
 |
 |
|
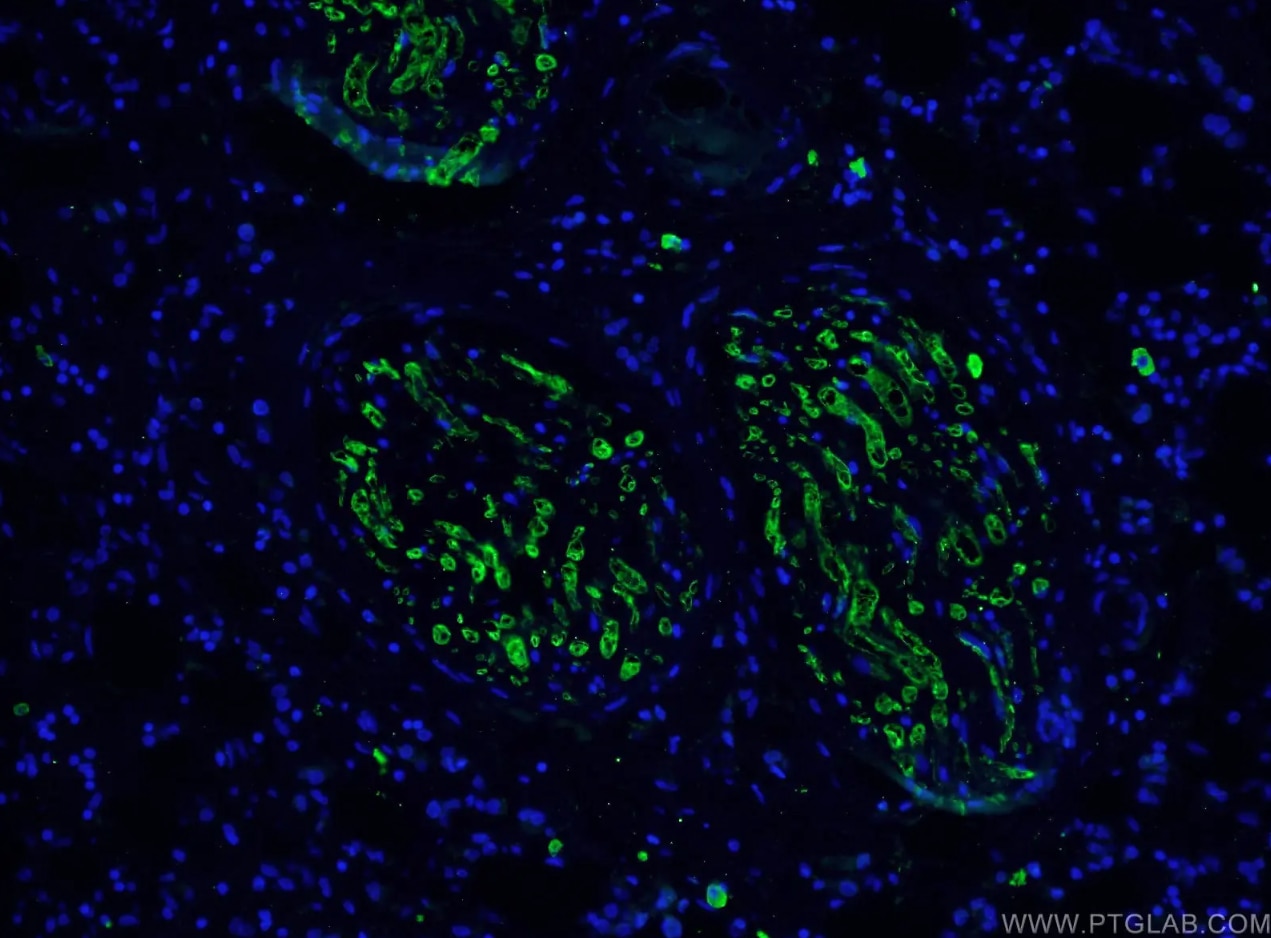
カスパーゼ3モノクローナル抗体(カタログ番号:66470-2-Ig、希釈倍率1:100)、Alexa Fluor488標識AffiniPureヤギ抗マウスIgG(H+L)抗体を使用した、ヒト乳がん組織の免疫蛍光染色解析像。 |
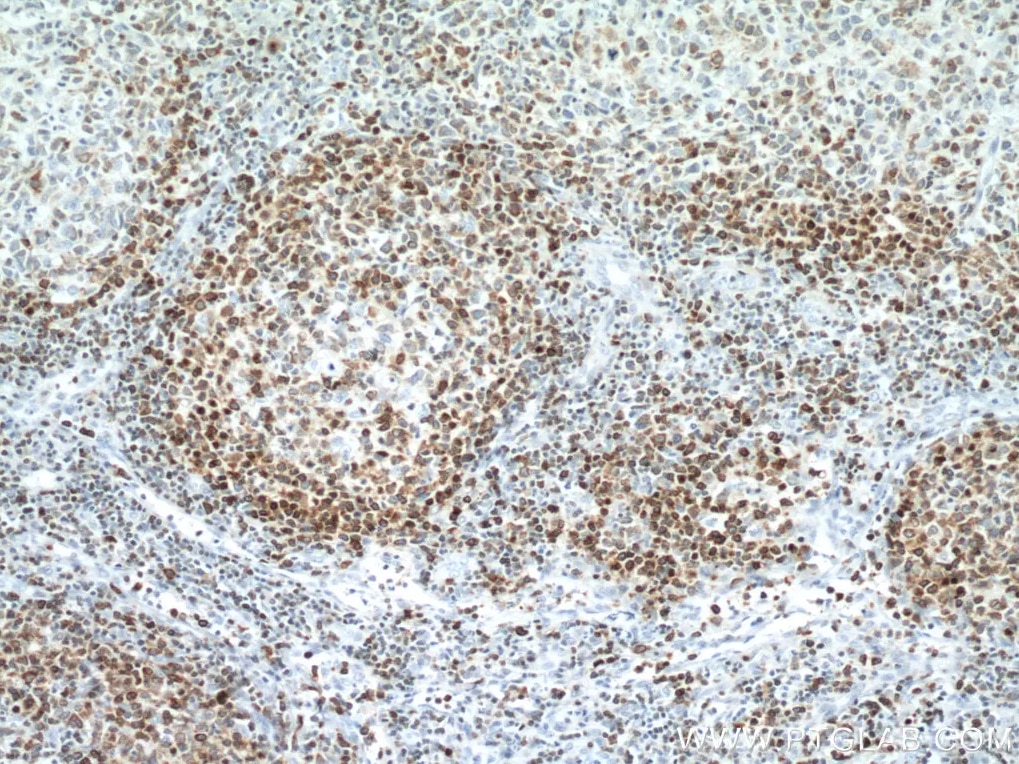
Bcl2モノクローナル抗体(カタログ番号:60178-1-Ig、希釈倍率1:12800)を使用した、ヒトリンパ腫組織の免疫組織化学染色。 |
表1:アポトーシスおよびパイロトーシス時の形態変化、メカニズム、制御機構
| アポトーシス | パイロトーシス | |
| 形態変化 |
|
|
| メカニズム |
|
|
| 制御機構 | RIPK1のユビキチン化が阻害されると、RIPK1とFADDおよびカスパーゼ8前駆体の会合が生じ、カスパーゼ8が活性化することで、最終的にRIPK1が切断されてアポトーシス性細胞死が引き起こされる。 | NLRP3の翻訳後修飾や、数通りのタンパク質リン酸化やユビキチン化を介して制御される。 |
| ミトコンドリアの関与 | ミトコンドリア由来のシトクロムcの放出と、アポトーシス小体形成がアポトーシスに関与する。 | リソソームのRagulator-Rag複合体とmTORC1複合体の相互作用は、ミトコンドリア由来の活性酸素種(ROS)の産生を刺激し、ガスダーミンD(GSDMD)の多量体化とそれに伴う細胞膜の孔形成に関与する。 |
参考文献
- D Bertheloot, et al. Necroptosis, pyroptosis and apoptosis: an intricate game of cell death. Cell Mol Immunol. 2021 May;18(5):1106-1121.
- T Bergsbaken, et al. Pyroptosis: host cell death and inflammation. Nat Rev Microbiol. 2009 Feb;7(2):99-109.
- P Yu, et al. Pyroptosis: mechanisms and diseases. Signal Transduct Target Ther. 2021 Mar 29;6(1):128.
- X Liu, et al. Inflammasome-activated gasdermin D causes pyroptosis by forming membrane pores. Nature. 2016 Jul 7;535(7610):153-8.
- Y Wu, et al. Cell pyroptosis in health and inflammatory diseases. Cell Death Discov. 2022 Apr 11;8(1):191.
- G Häcker. The morphology of apoptosis. Cell Tissue Res. 2000 Jul;301(1):5-17.
- S Elmore. Apoptosis: a review of programmed cell death. Toxicol Pathol. 2007 Jun;35(4):495-516.
- R Singh, et al. Regulation of apoptosis in health and disease: the balancing act of BCL-2 family proteins. Nat Rev Mol Cell Biol. 2019 Mar;20(3):175-193.
- R M Siegel. Caspases at the crossroads of immune-cell life and death. Nat Rev Immunol. 2006 Apr;6(4):308-17.
- D Tang, et al. The molecular machinery of regulated cell death. Cell Res. 2019 May;29(5):347-364.

