ネクローシス(Necrosis)とアポトーシス(Apoptosis)の違いとは?
細胞死(cell death)は、多細胞生物において自然に起こる現象です。細胞は内的刺激と外的刺激によって死滅します。
細胞死は、これまでに多様な事象が同定されています(PMID:29362479; (1))。細胞死は、大きく分けて「プログラム細胞死、または制御された細胞死(programmed cell death/regulated cell death、PCD/RCD)」および「偶発的な細胞死、または事故的細胞死(accidental cell death、ACD)」の二つのグループに分類されます。「プログラム細胞死、または制御された細胞死(programmed cell death/regulated cell death、PCD/RCD)」は、主にアポトーシスのことを指すことが多く、オートファジー、制御されたネクローシス(ネクロプトーシス等)も含まれます。「偶発的な細胞死、または事故的細胞死(accidental cell death)」は、感染や損傷等の非生理的状態による細胞死であり、ネクローシス(Necrosis、壊死)として知られます。
アポトーシス - プログラム細胞死/制御された細胞死(PCD/RCD)
アポトーシス(apoptosis)は、プログラム細胞死(PCD)の最も一般的な形態です。アポトーシスは、様々な物理的、化学的、および生物学的因子を介して誘発され、アポトーシスにおける細胞応答は厳密に調節されています。細胞内成分の制御された分解は、アポトーシス過程で活性化されるプロテアーゼファミリーである、カスパーゼによって調節されています(詳しくはこちら:カスパーゼカスケード抗体 )。
健康な細胞では、カスパーゼは不活性型のプロ酵素(proenzyme、酵素前駆体)として存在します。アポトーシスシグナル伝達はカスパーゼカスケード(カスパーゼ-2、-8、-9、10:イニシエーターカスパーゼと呼ばれる)を活性化します。イニシエーターカスパーゼは、次に下流のエフェクターカスパーゼ(カスパーゼ-3、-6、-7)を切断し、活性化します。エフェクターカスパーゼは、標的細胞タンパク質を切断してアポトーシスを実行します。アポトーシスを開始する刺激には、内因性と外因性のものがあります。内因性の刺激には、例えば、DNA損傷、小胞体ストレス、ROSレベルの増加、有糸分裂中の細胞不良が含まれます。外因性の刺激は、細胞膜の受容体を介して細胞によって検出されるものを指します(詳しくはこちら:カスパーゼカスケード抗体 )。
外因性アポトーシス(Extrinsic apoptosis)
外部から誘導されるアポトーシスには、2つの主要な受容体タイプが存在します。一つ目は、細胞死受容体(デスレセプター、death receptor)と呼ばれ、TNF受容体およびFas受容体等が知れています。これらは、それぞれの細胞外リガンド(TNF-αおよびFasリガンド:FasL)と結合します。これは、受容体の活性化と会合による複合体形成を促し、細胞内カスパーゼの活性化を誘導します。もう一方は、依存性受容体(dependence receptor)と呼ばれ、DCCやPTCH1等が知られています。これは、他のアポトーシス受容体と全く逆の感知機構に依存しています。依存性受容体は、生理的条件下では栄養因子(trophic factor)に応答し、抗アポトーシス刺激として作用します。しかしながら、そのリガンドが細胞外空間であるレベル以下に低下すると、リガンドと結合していない受容体はアポトーシス反応を引き起こします。
内因性アポトーシス(Intrinsic apoptosis)
内因性アポトーシスは、ミトコンドリア関連BCL-2ファミリーに属するタンパク質である、BAX(BCL2-associated X protein、BAX antibody: 50599-2-Ig)およびBAK(BCL2 antagonist/killer)によって媒介されます。BAKは、ミトコンドリア外膜の膜貫通タンパク質です。アポトーシスが誘導されると、BAXはコンホメーションの変化を起こします。これによって膜貫通ドメインが露出し、ミトコンドリア外膜にBAXが挿入されます。BAX-BAKヘテロ二量体は、ミトコンドリア孔を形成し、カスパーゼを活性化できるチトクロームc(cytochrome c)やDIABLO(diablo IAP-binding mitochondrial protein)タンパク質等、ミトコンドリアタンパク質を細胞質に放出します。
アポトーシス過程における変化
アポトーシスは、有意な細胞形態変化に反映されます(表1)。初期段階では、アポトーシスを起こした細胞は、細胞との接触を喪失し、形を変えます。また、クロマチンは核内で凝縮し、核膜に向かって移動します。核の凝縮(核濃縮、pyknosis/karyopyknosis)はDNAの分解を開始します。水の喪失は、他の細胞小器官の形態学的変化をほとんど、または全く伴わずに、顕著な細胞収縮および細胞膜でのブレブ形成(blebbing/ブレビング、水泡形成、水泡状突起形成)を引き起こすます。細胞膜の内層(細胞膜の細胞質側、inner layer/inner membrane)だけに存在する脂質であるホスファチジルセリンは、細胞膜表面である外層(細胞膜の外側、outer layer/outer membrane)に露出します。核と細胞質の断片は、アポトーシス小体(apoptotic bodies、断片化した核が細胞膜に包まれた凝集体)になります。そして、放出された細胞内プロテアーゼは、細胞骨格、細胞膜、およびタンパク質の崩壊を引き起こします。隣接するマクロファージは、アポトーシス小体を認識し、飲み込み、消化して(マクロファージによる貪食)、プロセスは完了します。
オートファジー - まれなタイプのプログラム細胞死
オートファジー(autophagy)は、栄養ストレス時の細胞内容物の自然分解プロセスです。マクロオートファジー(macro-autophagy)の場合、オートファゴソーム(autophagosome)とよばれる二重膜小胞の形成が関与します。オートファゴソームは、リソソームと融合してオートリソソーム(autolysosome)を形成します。この過程は、mTOR(mechanistic target of rapamycin、機械的ラパマイシン標的タンパク質)およびAtg関連遺伝子(Autophagy related gene、オートファジー関連遺伝子)にコードされたタンパク質によって開始されます(図1-2)。オートファジーは、飢餓状態の細胞に対して、細胞内で必須では無い細胞成分を消化して得られる栄養を供給することによって、その細胞の生存を促進すると考えられています。マクロオートファジーは、プログラム細胞死の経路の一つにもなり得ることが見出されています(PMID:22052193; (2))。プログラム細胞死において、アポトーシスほど一般的ではありませんが、発生過程の調節に何らかの役割を果たしてることが示唆されています。最もよく知られているのは、キイロショウジョウバエの幼虫-蛹移行期における特定の幼虫器官-唾液腺および中腸の除去です(PMID:18083103; (3)、19818615; (4))。また、オートファジー細胞死は、in vitroでの成体海馬神経細胞培養物で、インスリン除去に応答して観察されました(PMID:18653772; (5))。オートファジー依存性細胞死の主な特徴は、細胞質の広範な空胞化(autophagic vacuolization)です。一方で、アポトーシスにみられるようなクロマチン構成の変化は認められません(表1)。また、細胞残滓(cell remnant、細胞レムナント)は、アポトーシスで観察されるようなマクロファージ貪食で除去されません。オートファジーは、オートファジー細胞死をもたらしますが、抑制因子またはAtgタンパク質(例えば、Atg1、Atg5、Atg7)の枯渇によって阻害され得ます(図3)。
 |
|
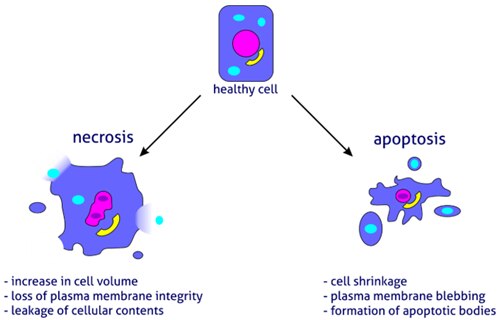
図1. 1:200の希釈倍率でATG5 抗体(品番: 10181-2-AP)を使用したパラフィン包埋ヒト大腸癌組織スライドの免疫組織化学(40倍レンズ下)。 |
 |
|
図2. 1:200の希釈倍率でULK1 抗体(品番: 20986-1-AP)を使用したパラフィン包埋ヒト骨格筋組織スライドの免疫組織化学(40倍レンズ下)。 |
 |
|
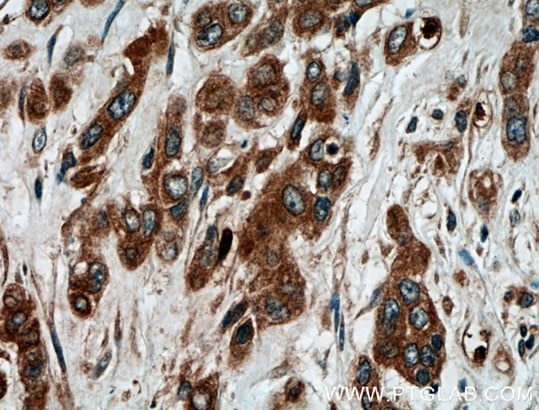
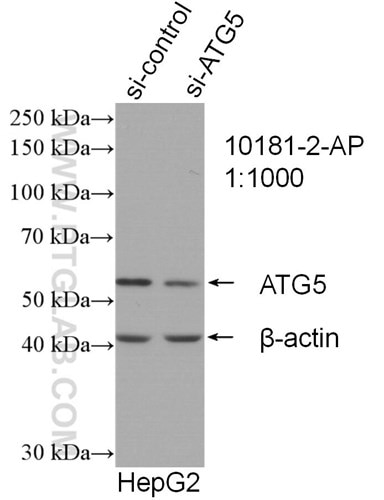
図3. 室温で1:1000の希釈倍率のATG5抗体(カタログ番号: 10181-2-AP)で1.5時間インキュベートした、sh-Controlおよびsh-ATG5をそれぞれトランスフェクションしたHepG2 cells細胞のウエスタンブロット。 |
ネクローシス過程における変化
ネクローシス(necrosis、壊死)は、細胞傷害の形態であり、機械的傷害や化学剤、病原体等の内部または外部のストレスに起因する制御されない細胞死、と定義されます。ネクローシスのプロセスは、通常迅速であり、浸透圧の喪失による細胞の膨張および破裂(オンコーシス、膨化死)を引き起こします(表1)。細胞膜の完全性が失われると、細胞内容物が細胞外へ漏出し、炎症反応が引き起こされます。細胞の崩壊に先立って、小胞体やミトコンドリアの膨張、ゴルジ装置の崩壊等、細胞小器官の破壊を含む一連の形態変化を生じます。細胞外マトリックスからのカルシウムイオンの流入は、DNAを断片化する細胞内ヌクレアーゼを活性化します。また、遊離したリソソーム加水分解酵素は、核酸とタンパク質の分解に寄与します。崩壊して生じた産物は、死んだ細胞の残滓物を貪食する、白血球、リンパ球、マクロファージを活性化します。
ネクロトーシス - 制御されたネクローシス。
ネクロトーシス(necroptosis)は、ネクローシス様の表現型を示す、制御された細胞死の一形態です。インターフェロン、デスリガンド、Toll様受容体などのストレス刺激に反応して引き起こされます(PMID:19524512; (6)、19524513; (7)、19498109; (8))。活性化は、セリン-スレオニンキナーゼであるRIP3受容体(Receptor interacting protein 3、RIPK3)を介して行われます(図4)。ネクロトーシスの初期段階にある細胞は、RIP3のリン酸化と、一般的にはネクロソーム(necrosome)として知られるRIP1とβアミロイド様タンパク質(β-amyloid-like protein)複合体の形成によって特徴づけられます。リン酸化されたRIP3は、MLKLのリン酸化によって下流で作用し(図5)、未だ完全には解明されていない機序でネクローシスを引き起こすことが示唆されています(PMID:30131615; (9))。
 |
|
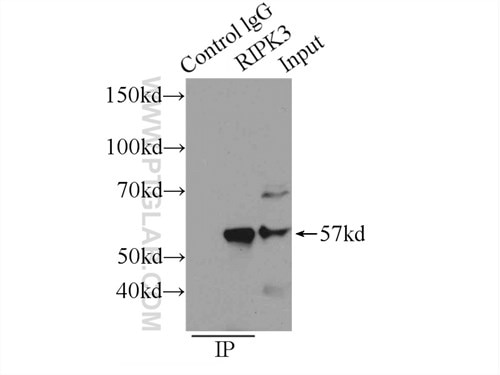
図4. SW 1990細胞3000ugを用いたRIP3 抗体(カタログ番号: 17563-1-AP、IP: 3ug、検出: 1:300)によるSW 1990細胞のIP-ウエスタンブロット。 |
 |
|
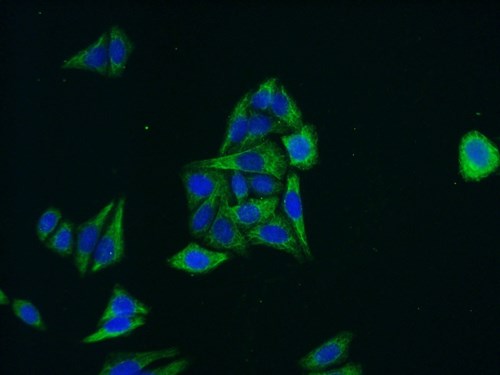
図5. 希釈倍率1:50でMLKL抗体(品番:21066-1-AP)およびAlexa Fluor 488コンジュゲートAffiniPureヤギ抗ウサギIgG(H+L)を使用したHepG2細胞(-20°Cエタノール固定)の免疫蛍光染色。 |
まとめ
The細胞死の2つの主なタイプは、アポトーシスとネクローシスです。それらは、細胞死プロセスを開始する刺激、形態学的および生化学的変化、細胞が用いるシグナル伝達経路の点で異なります。
ネクローシスは、不可逆的な細胞傷害がもたらす外的要因によって引き起こされ、細胞膜の完全性の喪失および急速な死を伴い、しばしば免疫系の活性化をもたらします。対照的に、アポトーシスは、多くの内部および外部経路によって開始されます。それらは、よく制御された過程であり、細胞残滓の緩やかな代謝回転および隣接するマクロファージによる食作用をもたらします。
表1. アポトーシス、オートファジー、ネクローシスの生理学的イベント
アポトーシス |
オートファジー |
ネクローシス |
||
形態的変化(Morphological changes) |
細胞(Cell) |
収縮と細胞間接触の喪失; アポトーシス細胞は隣接細胞を貪食する |
細胞質の広範な空胞化 |
膨張; 細胞溶解 |
|
細胞膜(Plasma membrane) |
膜完全性を保ちながらblebbing/ブレビング、水泡形成、後期段階でのアポトーシス小体の形成 |
膜完全性の喪失 |
膜完全性の喪失:膜透過性の増加 |
|
|
細胞小器官(Organelles) |
目に見える変化なし |
いくつかのケースでは、ゴルジ体と小胞体の拡大化が観察される |
細胞の断片化 |
|
|
核(Nucleus) |
クロマチン凝縮、断片化 |
クロマチン凝縮無し |
クロマチンの凝縮と核の崩壊 |
|
|
ミトコンドリア(Mitochondrion) |
潜在的な膜の変化、膨張 |
膨張が時々時々見られる |
非機能的、膨潤および断片化 |
|
生化学的変化(Biochemical changes) |
DNA |
エンドヌクレアーゼによる特定の長さの断片への切断(DNA laddering) |
ゲノムDNAのランダム分解 |
|
|
タンパク質(Proteins) |
キナーゼの活性化:ホスファターゼ、カスパーゼ、ヌクレアーゼ |
オートファゴソームでの酵素分解 |
非特異的な分解 |
|
|
抗アポトーシスタンパク質(Anti-apoptotic proteins) |
Bcl-2ファミリータンパク質、アポトーシス阻害因子(IAP)、カスパーゼ阻害剤 |
場合によっては Bcl-2 発現 |
||
|
エネルギー(Energy) |
ATP-依存的 |
異化プロセス |
ATP-非依存的 |
|
組織応答(Tissue response) |
|
|
|
|
細胞死後クリアランス(Post-death clearance) |
ファゴサイトーシス(食作用) |
ファゴサイトーシス(食作用)では無い |
細胞分解(Cell lysis) |
|
参考文献
- Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018.
- Cell death by autophagy: facts and apparent artefacts.
- Growth arrest and autophagy are required for salivary gland cell degradation in Drosophila.
- Autophagy, not apoptosis, is essential for midgut cell death in Drosophila. Autophagy, not apoptosis, is essential for midgut cell death in Drosophila.
- Autophagic death of adult hippocampal neural stem cells following insulin withdrawal.
- Receptor interacting protein kinase-3 determines cellular necrotic response to TNF-alpha.
- Phosphorylation-driven assembly of the RIP1-RIP3 complex regulates programmed necrosis and virus-induced inflammation.
- RIP3, an energy metabolism regulator that switches TNF-induced cell death from apoptosis to necrosis.
- RIP kinases as modulators of inflammation and immunity.

