ゲスト寄稿 | 糖鎖を認識するF-boxタンパク質の機能解析
吉田雪子先生よりご投稿いただきました
吉田 雪子 先生
Yukiko Yoshida
(公財)東京都医学総合研究所 ユビキチンプロジェクト
Products
実験内容
細胞内のタンパク質分解系には、ユビキチン鎖が付加した特定のタンパク質をプロテアソームが分解する「選択的分解系」と、栄養飢餓時などに細胞質に生じたオートファゴソーム膜の内容物を丸ごとリソソームに運んで分解する「非選択的分解系」があります。最近は、ミトコンドリアなどの損傷を受けたオルガネラもまたユビキチン化を受け、「選択的オートファジー」により分解されるメカニズムも解明されてきています。オートファジーによる分解のマシナリーであるリソソームもまた、シリカや尿酸などの取り込みで損傷を受けると、ユビキチン化された後オートファジーにより除去される「リソファジー」という現象が報告されていました(文献1)。しかし、リソソームの損傷を細胞が感知する機構についてはよく分かっていませんでした。
糖タンパク質は細胞の表層やオルガネラの内側に存在し、通常は細胞質には存在しません。私たちは糖鎖を認識するSCF複合体型ユビキチンリガーゼの基質認識サブユニットFBXO27が、通常は糖タンパク質が存在しない細胞質に存在し、損傷を受けたリソソームから細胞質へ漏れ出た糖タンパク質の糖鎖を感知することでリソソーム内の糖タンパク質をユビキチン化し、リソファジーを引き起こすことを明らかとしました(図1)(文献2)。
ヒトでは約600種類存在するユビキチンリガーゼが、どのタンパク質にユビキチンを付加するかを決定します。SCF複合体はおよそ70種類ある基質認識サブユニットF-boxタンパク質を入れ替えることで様々な基質に対応するタイプのユビキチンリガーゼです。ごく数種類のF-boxタンパク質は非常に多くの研究がなされていますが、多くのF-boxタンパク質は機能が分かっておらず、市販の抗体も揃っていません。FBXO27は相同性の高いタンパク質が存在するため抗原領域の設計が難しく、私たちは数度にわたり抗体の作製を行いましたが、内在性のタンパク質を検出できる抗体を得ることはできませんでした。Proteitech社では抗FBXO27抗体を扱っていましたが、十分な社内検証を完了していないという理由で評価結果を提供することを条件としてサンプルとしてご供与いただきました(※)。ウエスタンブロットで推定される分子量の場所にバンドが検出できたものの、慎重を期してsiRNAでノックダウン実験も行い、正しくFBXO27を認識できていることも確認できました(図2)。ノックアウト細胞作製の難しいPANC-1細胞でしたがこの抗体を用いて、FBXO27ノックアウト細胞を得ることができました。
Proteitech社では32種類ものF-boxタンパク質の抗体の取り扱いがあります(表1)。これらの中にはFBXO27同様にこれまで解析されていなかったものも多くあります。新たな機能解明のためのツールとしての利用が期待されます。
※2018年3月現在、検証中(販売開始前)抗体商品の無償サンプル提供は実施しておりません。
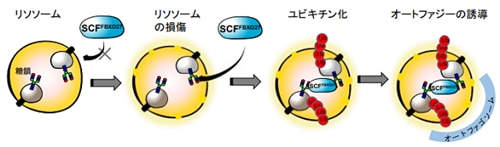
図1.FBXO27による損傷リソソームの認識とオートファジーの誘導機構
細胞質にあるFBXO27と糖タンパク質は膜で隔てられているが、リソソームに損傷が起こると、リソソームの内部の糖タンパク質糖鎖にFBXO27がアクセスできるようになる。SCFFBXO27ユビキチンリガーゼはリソソーム内の糖タンパク質をユビキチン化することが引き金となり、オートファジーが誘導される。
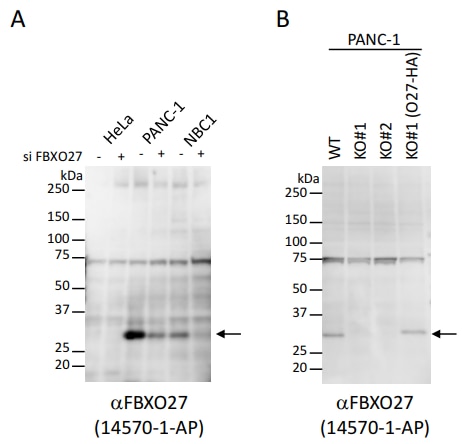
図2.抗FBXO27抗体を用いたウエスタンブロッティングによる内在性タンパク質の検出
A. 内在性FBXO27の検出。各々の細胞はFBXO27 siRNA(Dharmacon M-018558)で48時間処理した。15 µgの細胞抽出液/レーン。PANC-1, NBC1では内在性のFBXO27の発現が見られ、siRNA処理で発現が減弱する。FBXO27の発現が極めて弱いHeLa細胞(7.15E+02; Kulak et al., Nature Methods 11,319-324)では該当する分子量の場所にバンドは認められない。
B. CRISPR-Cas9系によって樹立したFBXO27 KO細胞とKO細胞にFBXO27-HAを入れ戻した細胞でのFBXO27の検出。
| 抗体名 | 品番 |
|---|---|
| FBXW2 | 11499-1-AP |
| FBXW4 | 10657-1-AP |
| FBXW5 | 18321-1-AP |
| FBXW7 | 55290-1-AP |
| FBXL8 | 16505-1-AP |
| FBXW11 | 13149-1-AP |
| FBXW12 | 21687-1-AP |
| FBXL1(SKP2) | 15010-1-AP |
| FBXL11(KDM2A) | 24311-1-AP |
| FBXL13 | 17139-1-AP |
| FBXL14 | 13934-1-AP |
| FBXL15 | 20895-1-AP |
| FBXL16 | 25950-1-AP |
| FBXL18 | 11556-1-AP |
| FBXO2 | 14590-1-AP |
| FBXO3 | 17803-1-AP |
| FBXO5 | 10872-1-AP |
| FBXO6 | 11830-1-AP |
| FBXO7 | 10696-1-AP |
| FBXO8 | 11903-1-AP |
| FBXO9 | 11161-1-AP |
| FBX15 | 13024-1-AP |
| FBXO17 | 12844-1-AP |
| FBXO22 | 13606-1-AP |
| FBXO18 | 14275-1-AP |
| FBXO27 | 14570-1-AP |
| FBXO28 | 24282-1-AP |
| FBXO31 | 27294-1-AP |
| FBXO32 | 12866-1-AP |
| FBXO41 | 24519-1-AP |
| FBXO43 | 55176-1-AP |
| FBXO44 | 10626-1-AP |
参考文献
1. Maejima, I., Takahashi, A., Omori, H., Kimura, T., Takabatake, Y., Saitoh, T., Yamamoto, A., Hamasaki, M., Noda, T., Isaka, Y., Yoshimori, T. (2013). Autophagy sequesters damaged lysosomes to control lysosomal biogenesis and kidney injury. EMBO J 32, 2336-2347.
2. Yoshida, Y., Yasuda, S., Fujita, T., Hamasaki, M., Murakami, A., Kawawaki, J., Iwai, K., Saeki, Y., Yoshimori, T., Matsuda, N., Tanaka, K. (2017). Ubiquitination of exposed glycoproteins by SCFFBXO27 directs damaged lysosomes for autophagy. PNAS 114, 8574-8579.