老化の秘密を解き明かす:細胞老化におけるエピジェネティクスの役割
Shiksha Dutta著(Montreal大学、博士課程在籍)
|
目次 |
細胞老化とは?
加齢は人生において避けることのできない現象ですが、もし加齢の機構をより理解できたらどうなるでしょうか?細胞老化(Cellular senescence)は、細胞が遺伝毒性ストレスやDNA損傷等の多様な細胞ストレス因子に反応して分裂を停止し、著しい変化を受ける重要なプロセスです(図1)。細胞老化は、それに伴う細胞分裂停止(SAPA:senescence-associated proliferation arrest)と免疫応答活性化により細胞の増殖を制限することで、腫瘍抑制機構という重要な役割を果たします。また、組織リモデリング機構によって組織の恒常性を維持し、創傷治癒を促進します。しかし、加齢に伴う老化細胞の蓄積は、主としてがんの進行や加齢による臓器病態と関係します。そのため、初期段階の細胞老化が腫瘍抑制機構としての機能を果たす一方で、老化細胞の蓄積はがん、慢性炎症、加齢、加齢性疾患の一因となります。
細胞老化は、一連のオートクライン・パラクライン性の炎症誘発性因子を特徴とします。これらの因子は、細胞老化に伴う炎症性タンパク質を中心とする分泌現象である細胞老化随伴分泌現象(SASP:Senescence-associated secretory phenotype)の非常に重要な因子です。SASPは組織の微小環境をリモデリングし、加齢に伴う老化細胞の蓄積に寄与します。SASPの因子には、インターロイキン(IL-6、IL-7、IL-13、IL-15)、ケモカイン(IL-8、MCP-2、MCP-4、MCP-1)、増殖因子やその他の分泌タンパク質(VEGF、IGFBP-2、IGFBP-3、IGFBP-4、IGFBP-6、IGFBP-7)のような可溶性シグナル伝達因子、プロテアーゼの分泌(MMP-1、MMP-3、MMP-10、MMP-12、MMP-13、MMP-14)、細胞外マトリックスの変化等があります。また、細胞の老化現象は、細胞毒性薬物、酸化、放射線照射、発がん遺伝子誘導ストレス等の遺伝毒性ストレスによるDNA二本鎖切断(DSB:DNA double-strand break)に起因する現象でもあります。この生物学的プロセスにおける中心的存在であるのが、p53/p21やp16INK4a/Rb等の腫瘍抑制経路です。これらの経路は、細胞周期の進行と増殖を制御するキナーゼを阻害します。エピジェネティクス修飾は遺伝子発現の操り手として機能し、加齢に伴って腫瘍抑制経路をどのように活性化するか、あるいはどのように抑制するかを制御します。したがって、分裂細胞が老化細胞へと移行する過程は、エピジェネティクスのロードマップに従って進行するといえます。
細胞の老化は、細胞毒性薬物や放射線照射のような外因性因子によって誘導されると同時に、テロメア(染色体の末端部に存在する保護キャップ構造)の短縮が原因となって引き起こされることもあります。テロメアの短縮は、テロメラーゼの機能障害による影響に加え、老化の過程で細胞分裂が繰り返されると避けられない結果として生じます。DNAが5’末端から3’末端に複製される際にテロメラーゼが働くおかげでテロメアはすぐに短縮せずに長さを維持することができますが、その過程は完全なものではなく、細胞分裂のたびにテロメア部分の塩基対は消失します。テロメアの短縮速度は、社会経済的状況、ストレス、喫煙等のエピジェネティックな変化をもたらす様々な要因の影響を受けます。テロメアの長さがDNA保護作用を発揮できなくなるレベルに達すると、細胞はそれでも分裂を続けてがん化するか、アポトーシスを起こすか、あるいは老化状態に移行するかのいずれかの状態になります。このようなテロメア短縮による細胞老化誘導経路は、細胞ストレスに基づく他の経路と同様に、加齢に伴う老化細胞の蓄積の大きな一因となります。
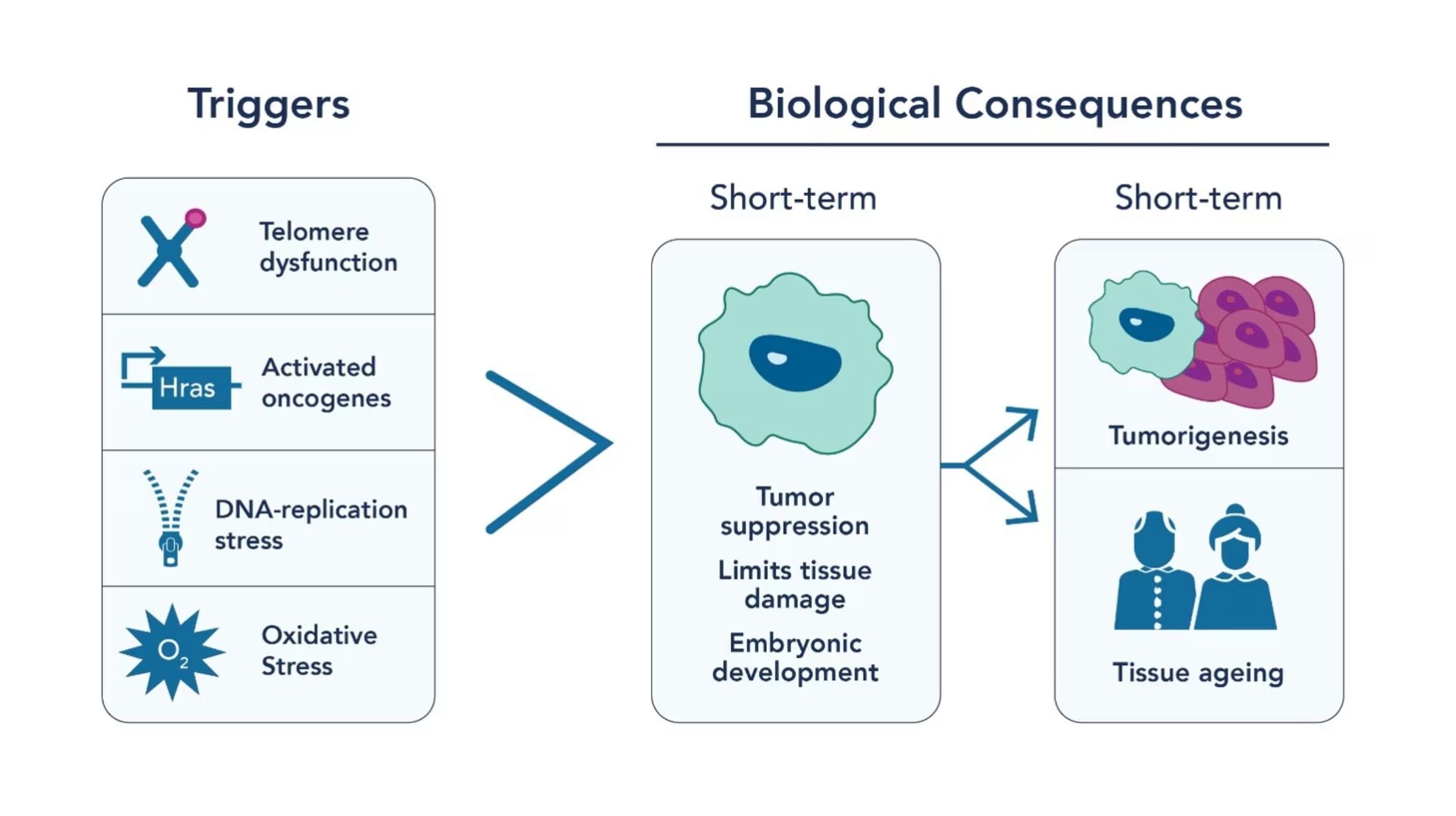
図1. 細胞老化の誘発要因
エピジェネティクスが細胞老化を制御する仕組み
ヒストン修飾
エピジェネティクスの分野では、DNA配列そのものの変化を伴わずに生じる遺伝子機能の変化を研究します。エピジェネティクス因子は、ヒストン修飾やノンコーディングRNA等による機構を介して、いつどのように遺伝子が発現するか、あるいは発現スイッチを「オン」の状態にするかを制御します。クロマチン構造とは、細胞の核内に存在するDNAとタンパク質からなる構造を指し、この構造によってDNAをコンパクトな形状で効率的に核内に収納することができます。クロマチンの構造は遺伝子発現、DNAの複製、DNAの修復を制御するうえで非常に重要な役割を果たします。ヒストンはクロマチン構造に関与する主要なタンパク質で、DNAが巻き付くビーズのような足場として機能し、ヌクレオソームと呼ばれるユニットを構築します。ヒストンには、H1、H2A、H2B、H3、H4の主要な5種類のヒストンが存在します。H2A、H2B、H3、H4の各ヒストンが2分子ずつ集合すると、DNAが巻き付く核となるコアヒストンを形成します。一方、H1はヌクレオソームの高次構造形成・安定化に関与します。クロマチン構造の形成は、DNAをコンパクトに折りたたむだけでなく、転写やその他のDNA関連プロセスに関与する因子が特定のDNA領域の配列へアクセスするうえで重要な役割を果たします。
近年の研究により、老化細胞におけるエピジェネティクスの全体像が明らかになりつつあり(図2)、加齢機構や治療ターゲット候補に関する知見がもたらされています。これまでの研究から、老化に関連する遺伝子発現にはアセチル化やメチル化といった複数のヒストン翻訳後修飾が必須であることが明らかにされています。例えば、SASPをコードする遺伝子の発現には、ヒストンH3のK27残基(H3K27)のアセチル化やBRD4(bromodomain-containing protein4)の動員が必須であることが判明しています。BRD4を阻害すると、SASP関連因子の発現が抑制され、免疫応答に影響が及びます。同じように、SASPの活性化にはH3K4をメチル化するヒストンメチルトランスフェラーゼMLL1(Mixed-lineage leukemia 1)や、H3K79をメチル化するDOT1L等のメチル基転移酵素の存在が必須です。老化細胞ではDNAメチル化の減少が観察され、この現象はDNMT1(DNA methyltransferase 1)の減少が原因の1つであることが、様々な研究で明らかになっています。複製老化細胞(複製老化:細胞分裂に伴うテロメアの短縮を原因とする老化)ではメチル化パターンの変化が認められますが、特に免疫応答遺伝子のメチル化パターンが変化します。さらに、DNAの特定の領域の経時的なメチル基の付加や除去を解析すると、DNAメチル化パターンから実年齢を予測できます。このようなDNA領域はCpG部位といい、生体の年齢と相関したメチル化の変化を受けます。老化細胞のメチル化プロファイルは、老化個体の細胞やがん細胞で類似したパターンを有しますが、特定のCpG領域には明確な違いが認められます。
クロマチン構造
老化細胞のエピジェネティックな変化の過程ではクロマチン構造も変化しますが、特にヘテロクロマチンの減少と不安定化が認められます。クロマチン構造が変化することによって、それまでは抑制されていた遺伝子の転写活性が上昇します。増殖細胞では、ポリコーム抑制性複合体(PRC:polycomb repressor complexes)のようなクロマチン修飾作用を有するタンパク質が老化に関連する遺伝子発現を抑制します。さらに、PANDAのようなノンコーディングRNAと転写因子NF-YA(Nuclear transcription factor Y subunit alpha)との間の相互作用が、老化を制御するうえで重要な役割を果たします。SAHF(Senescence-associated heterochromatin foci)は、老化細胞に特有なもう1つのエピジェネティックな特性を有する構造です。この特殊なヘテロクロマチン領域では細胞増殖を促進する遺伝子が抑制されます。SAHFの形成は、ヒストンバリアントだけでなく、細胞の種類や老化誘導機構の影響も受けます。老化細胞では、H3.3、macroH2A、H2A.J、H2A.Zのようなヒストンバリアントが顕著に優勢になります。これらのヒストンバリアントは転写制御、DNA修復、エピジェネティックな状態の維持に極めて重要な役割を果たすため、SAHFの形成にもSASP遺伝子発現にも大きな影響を与えます。
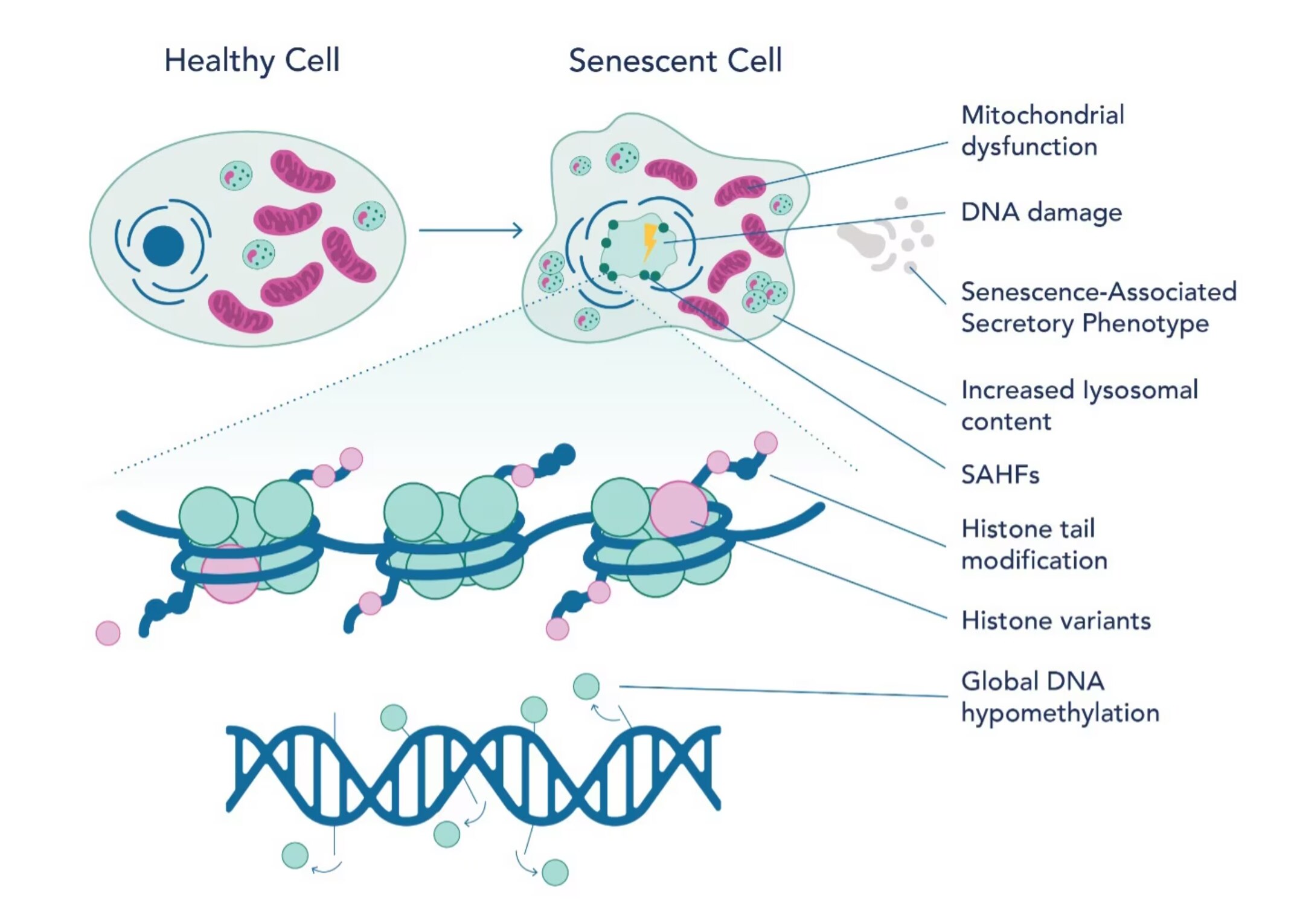 図2. 老化細胞におけるエピジェネティクスの全体像
図2. 老化細胞におけるエピジェネティクスの全体像
最後に
細胞老化におけるエピジェネティクス制御の研究により、加齢等の機構を統制する、複数の因子からなる複雑な機構のネットワークが明らかになっています。ヒストン修飾とDNAメチル化パターンが果たす役割から、クロマチン構造とノンコーディングRNAの間の刻一刻と変化する相互作用が果たす役割にいたるまで、エピジェネティクス研究の成果は、エピジェネティクス因子が細胞の挙動に及ぼす多大な影響を浮き彫りにしています。こうした知見は細胞の老化に関する理解を高め、加齢に関連する疾患への治療介入の新たな道筋を開きます。エピゲノムの謎が解明されていくにつれ、その新たに発見されたエピジェネティックなプロセスを操作することが、加齢の影響の緩和やヒトの健康寿命の向上の鍵となり得るエビデンスが蓄積しつつあります。エピジェネティクスをどう活かすかが今後の加齢研究の鍵となり、加齢の課題に対する新しい戦略を開発するうえで大きな可能性をもたらしています。
プロテインテックのエピジェネティクス/細胞老化関連抗体
|
ターゲット |
カタログ番号 |
|
Histone H2A.X |
|
|
Histone H2A.Z |
|
|
Histone H2B |
|
|
Histone H3 |
|
|
Acetyl-Histone H3 (lys27) |
|
|
BRD4 |
|
|
MLL |
|
|
DNMT1 |
|
|
NFYA |
|
|
P16-INK4A |
|
|
CDKN2A |
|
|
P21 |
|
|
P53 |
編集:Ben Raven(Sheffield大学、博士課程在籍)
参考文献
- F Rodier, J Campisi. Four faces of cellular senescence. J Cell Biol. 2011 Feb 21;192(4):547-56.
- N Malaquin, A Martinez, et al. Keeping the senescence secretome under control: Molecular reins on the senescence-associated secretory phenotype. Exp Gerontol. 2016 Sep:82:39-49.
- E Pazolli, SA Stewart, et al. Chromatin remodeling underlies the senescence-associated secretory phenotype of tumor stromal fibroblasts that supports cancer progression. Cancer Res. 2012 May 1;72(9):2251-61.
- B Li, et al. The role of chromatin during transcription. Cell. 2007 Feb 23;128(4):707-19.
- JP Coppé, CK Patil, F Rodier, et al. Senescence-associated secretory phenotypes reveal cell-nonautonomous functions of oncogenic RAS and the p53 tumor suppressor. PLoS Biol. 2008 Dec 2;6(12):2853-68.
- AR Lera, A Ganesan. Two-hit wonders: The expanding universe of multitargeting epigenetic agents. Curr Opin Chem Biol. 2020 Aug:57:135-154.
- C Sidler, O Kovalchuk, I Kovalchuk. Epigenetic Regulation of Cellular Senescence and Aging. Front Genet. 2017 Sep 26:8:138.
- Y Astuti, W Wulaningsih, et al. Cigarette smoking and telomere length: A systematic review of 84 studies and meta-analysis. Environ Res. 2017 Oct:158:480-489.
- SE Alexeeff, et al. Telomere length and socioeconomic status at neighborhood and individual levels among 80,000 adults in the Genetic Epidemiology Research on Adult Health and Aging cohort. Environ Epidemiol. 2019 May 1;3(3):e049.
- MB Mathur, et al. Perceived stress and telomere length: A systematic review, meta-analysis, and methodologic considerations for advancing the field. Brain Behav Immun. 2016 May:54:158-169.
- H Wang, H Fu, R Zhu, et al. BRD4 contributes to LPS-induced macrophage senescence and promotes progression of atherosclerosis-associated lipid uptake. Aging (Albany NY). 2020 May 11;12(10):9240-9259.
- BC Capell, et al. MLL1 is essential for the senescence-associated secretory phenotype. Genes Dev. 2016 Feb 1;30(3):321-36.
- KE Leon, et al. DOT1L modulates the senescence-associated secretory phenotype through epigenetic regulation of IL1A. J Cell Biol. 2021 Aug 2;220(8):e202008101.


