ヒントとコツ | 免疫沈降(IP)実験のための8つのヒント
免疫沈降実験で良好な結果を得るための、8つのポイントを解説します。
はじめに
免疫沈降(IP)は、多くのタンパク質が含まれている「混沌」とした混合物の溶液から目的タンパク質だけを単離するための十分に確立された技術です。組織ホモジネート(懸濁液)や細胞ライセート(溶解物)等の溶液が対象になりますが、ゴールは同じです。すなわち、目的とする特定タンパク質以外は分離せず、特定タンパク質を1種類だけ分離するか、共免疫沈降(CoIP:Co-immunoprecipitation)の場合はごく限られたタンパク質だけを共に分離することが最終目標です。タンパク質免疫沈降の手順を修正改変した、クロマチンを単離する手法(ChIP:Chromatin immunoprecipitation)やRNAを単離する手法(RIP:RNA immunoprecipitation)も存在しますが、本稿ではタンパク質を単離する通常の免疫沈降法に焦点を当て、良好な結果を得るための実験のポイントを紹介します。
プロテインテックのアプリケーションサポート:免疫沈降法(Immunoprecipitation)
1. ライセートの調製
英語には「You only get out what you put in(「あなたが入れたものだけを、あなたは受け取るのだ」(意訳:注いだ分の努力から結果は生まれる))」という古い格言がありますが、これはIP実験にも当てはまります。つまり、溶液0.2~0.5mLあたり1~4mgの総タンパク質を回収することを目標として、「十分な量」のサンプルを準備してください。また、細胞や組織を破砕する操作を実施する間、目的タンパク質の状態をできるかぎり適切に保つことを目指す必要があります。その際、微妙なバランスが大切になります。理想的な溶解バッファーは、タンパク質のネイティブなコンホメーションを維持し、抗体結合部位の変性を最小限に抑えるだけでなく、十分な量のタンパク質を溶解させることができ、捕捉(キャプチャー)および解析のために効率的なサンプル調製を行う役割を担います。プロテインテックのラボでは通常「RIPAバッファー」を使用しています。RIPAバッファーは、効率的に細胞を溶解しタンパク質を可溶化できると同時に、タンパク質のエピトープや生物学的活性部位の分解や干渉を回避させます。また、RIPAバッファーを使用することで、IPのバックグラウンドを抑えることができます。特に、核抽出物の核膜の破砕に便利です。一方、リン酸化酵素(キナーゼ)を変性させてしまう場合があるため、キナーゼ活性を調べる場合は注意が必要です。RIPAバッファーを使用する際には、プロテアーゼ阻害剤を必ず添加しましょう(タンパク質のリン酸化について調べる場合はホスファターゼ阻害剤も必ず添加してください)。
RIPAバッファーの組成はプロテインテックのプロトコールに掲載しています。RIPAバッファー以外のバッファーを検討する場合は、可能であれば塩と界面活性剤の濃度は低く抑えた方が良いでしょう。バッファーの組成は十分に検討と検証を実施し(参考資料はprotocol-online(protocol-online.org)等の科学フォーラムで閲覧できます)、バッファー組成を微調整する必要がある場合はHarlow, Laneらによる著書(参考文献参照)の231ページで推奨されている範囲内におさめるよう留意します。
2. 最適な抗体の選択
目的タンパク質の捕捉には、可能であればポリクローナル抗体の使用をおすすめします。その理由を図1にわかりやすく図解しています。通常、IP実験の開始段階では抗原‐抗体複合体を形成させます。ポリクローナル抗体は目的タンパク質上の複数のエピトープに結合するため、より多くの目的タンパク質を保持します。最終的に不要なタンパク質や夾雑物はすべて洗浄されるため、サンプルも同時に洗い流されてしまわないような高い保持率が求められます。したがって、目的タンパク質を高い効率で捕捉および保持できるポリクローナル抗体がIP実験に使用する抗体の第一候補となります。
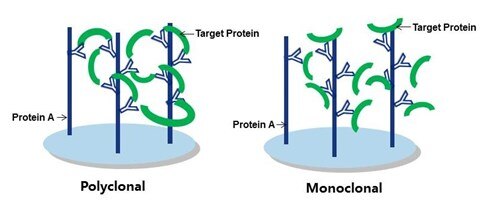
図1:捕捉抗体としてのポリクローナル抗体vsモノクローナル抗体。ポリクローナル抗体の方が、保持率が高く、強固に結合した抗原‐抗体複合体を形成します。
プロテインテックが豊富に取り揃えるポリクローナル抗体は、上述した抗体に求められる要件を満たし、ネイティブかつインタクトなエピトープを良好に認識することからIPに最適な抗体です。ネイティブなエピトープは三次元構造を維持しています。プロテインテックの抗体は、全長タンパク質を免疫原に使用して作製されるため、タンパク質全体を認識するポリクローナル抗体が産生され、IPのサンプル中のインタクトなタンパク質を良好に認識します(ポリクローナル抗体は目的物質の捕捉に最適な一方、ウェスタンブロット(WB)によって目的タンパク質を確認する場合はモノクローナル抗体の方が適しています。詳細は後ほど解説します)。
3. プレクリア処理を実施すべきか、実施しないべきか
プレクリア処理(Preclearing)とは、IPに使用する固相担体に非特異的に結合する非特異的タンパク質、脂質、炭水化物、核酸等を除去するステップを指します。プレクリア処理は、IPに使用する捕捉抗体の非存在下で、固相担体(例:アガロースビーズ)とライセートとをインキュベーションすることで実施します。インキュベーション後、プレクリア処理に使用した固相担体を除去・廃棄し、固相担体に結合したすべての物質をサンプルから取り除きます。このステップを実施するか否かは、固相担体の種類によって異なります。固相担体の中には特定のタンパク質に非特異的に結合する傾向を示す担体もあり、まずは製造メーカーの推奨事項を確認してください。また、捕捉抗体の特異性や親和性等の機能がどの程度優れているか、目的タンパク質がどの程度ライセート中に含まれているかによって実施の有無を判断します。プレクリア処理を実施しなくても良い場合もあります。
また、捕捉抗体と同じアイソタイプを持つ非特異的抗体を添加してプレクリア処理を実施する場合もあります。この操作を実施すると、免疫沈降の際に捕捉抗体の抗原結合部位以外の領域に対して非特異的に結合する物質をすべて除去することができます。
通常、プロテインテックのラボではIPの検証実験を実施する際にライセートのプレクリア処理を実施していません。その理由は、ルーチン業務として多数のIP試験を実施する場合に様々なライセート検体に対するプレクリア処理工程の実施と管理、プレクリア処理の有無による比較と評価が煩雑であるためです(上述の通り、プレクリア処理の必要性は個別のケースでご判断ください)。したがって、プレクリア処理は必ずしも必要なわけではありません。また、プレクリア処理に使用する溶液の量を注意深く検討し、実施する際は無駄なサンプルのロスを防ぐ必要があります。
4. 洗浄・溶出—実施方法の検討
遠心分離がIP実験の結果に及ぼす影響は、多くの場合過小評価されています。免疫複合体を遠心分離する際に回転速度が速すぎると、形成された複合体中の抗原-抗体間の相互作用が崩壊し、溶出操作前のサンプルロスの原因となります。そのため、洗浄や溶出処理時においては遠心分離の操作を省略する方法を採用するか、できるかぎり穏やかに行うことを推奨します。比較的大きいスケールの場合は、遠心分離を実施する代わりに容器にフィルターカラムをセットし、自然落下方式(gravity flow)を利用して洗浄を実施した後、溶出を実施し溶出液を回収します。
5. 溶出サンプルと煮沸サンプルの比較
従来のシグナルノイズ比(S/N比)の改善手段では、効率的に免疫複合体を解離することを犠牲にして、IPの最終段階で可能な限り多くの目的タンパク質を回収することを目指していました。この従来のタンパク質の回収率を改善する操作には、還元剤を含まない溶出バッファーの使用や、SDS-PAGE前の煮沸操作の省略等が挙げられます。時には溶出操作を完全に除外し、洗浄後、固相に結合したままのサンプルを煮沸する場合もあります。WBの結果を見ると、目的のシグナルは強くなりますが、固相が存在していたことが原因で多量の非特異的染色が認められます(図2)。こうした方法は行わず、サンプルをゲルにロードする前に、まず固相担体からサンプルを溶出させることを強く推奨します。
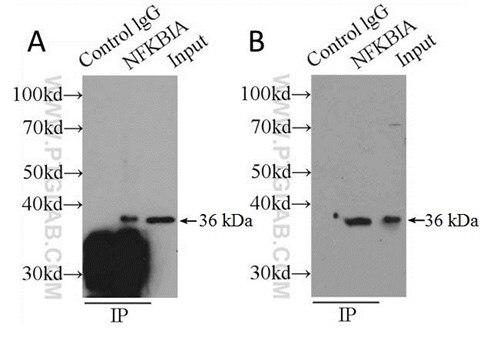
図2:(A)洗浄後に(固相担体と結合したまま)煮沸したサンプルと、(B)pH2のバッファー(150 mMグリシン、500 mM NaCl)を使用して溶出し、SDS-PAGEゲルにローディングする前に中和して煮沸したサンプルのWBの比較。捕捉抗体および検出抗体には抗NFKBIA抗体(カタログ番号:10268-1-P)を使用し、検出はHRP結合プロテインAを使用して実施した(代替検出法の項を参照)。使用ライセート:HeLa細胞。
6. 各実験操作で得られた画分を保存する
免疫沈降がうまくいかなかった場合に備え、各操作で得られた画分(プレクリア処理で得られたサンプルも含みます)は保存しておき、後々SDS-PAGEで解析することを推奨します。
7. 抗体ペア
例えば、免疫沈降の捕捉用に特定の動物種由来の抗体を使用し、WBの検出用にその他の動物種由来の抗体を使用する、というように抗体を組み合わせて使用する際は、さらに追加の検討を実施します。抗体選択プロセスでは、2種類の抗体が異なる種に由来することに加え、目的タンパク質の異なるエピトープを認識するか確認してください。抗体の種類(例:ポリクローナル抗体、モノクローナル抗体)も重要となります。もし可能であれば、捕捉用ポリクローナル抗体と検出用モノクローナル抗体を併用すると、捕捉効率が最大化し、高い検出特異性を得ることができます(図3参照)。
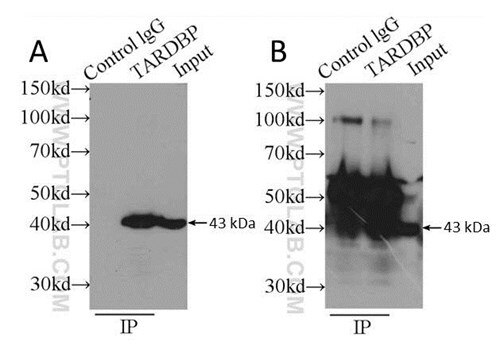
図3:(A)捕捉用ウサギポリクローナル抗体(カタログ番号:10782-2-AP)および検出用マウスモノクローナル抗体(カタログ番号:60019-1-Ig)の両方を使用した場合と、(B)同一のウサギポリクローナル抗体(カタログ番号:10782-2-AP)を捕捉と検出に使用したWBの比較。二次抗体による検出は、(A)HRP標識ヤギ抗マウス抗体、および(B)HRP標識ヤギ抗ウサギ抗体を使用して実施した。細胞ライセートにはK-562細胞(全画分)を使用した。
8. 代替検出法の検討
過去にIP実験を実施した経験者であれば、捕捉抗体の重鎖(HC:heavy chain)および軽鎖(LC:light chain)が目的タンパク質のシグナルに干渉することを知っているでしょう。この現象は、捕捉と検出に同一の抗体を使用している場合、避けることのできないアーチファクトで、回避するためには二次抗体による検出に種特異的な抗体を使用します。目的タンパク質を検出する別の方法については、BioTechniques 3月号に掲載されているアプリケーションフォーラム記事(future-science.com)をご覧ください。IPの操作全体で1種類しか抗体を使用しない場合でも、HCまたはLCバンドのシグナル干渉を回避できる方法を紹介しています。
参考文献
Harlow, Ed, and David Lane. Using Antibodies. Cold Spring Harbor, New York: Cold Spring Harbor Laboratory Press, 1999.
Bonifacino, Juan S. et al. Current Protocols in Immunology 8.3.1-8.3.28, New York: John Wiley, 2001.

