ゲスト寄稿 | 血管系の概要および内皮細胞の重要性
Kathryn Green(ノッティンガム大学博士課程)著
血管系(vascular system)は、身体にとって最大の輸送ネットワークとみなすことができます。また血管の構成要素の1つである内皮細胞(endothelial cell)は血管ネットワークの恒常性維持において極めて重要な役割を果たします。
血管系の発達機構とは?
血管系は、議論の余地はあるにせよ、ほぼ間違いなく身体の中で最も重要な役割を果たすシステムです。高等生物の血管系は、効率的な循環系に欠かせない系であり、身体中の細胞へ生命の維持に必須となるガスや栄養素の輸送を促進します。発生の初期段階では、血管芽細胞(angioblast)から血管がde novo形成される「脈管形成(vasculogenesis)」と呼ばれるプロセスによって最初の血管が生じます。しかし、脈管形成のプロセス以降、新たな血管は既存の脈管構造(vasculature)から、多くの場合、分枝や出芽によって新たな血管が形成される「血管新生(angiogenesis)」によって形成されます[1]。発生と成長の期間、血管新生は組織の需要を維持するために生じます。しかし、完全に発達した成人では、血管新生プロセスは創傷治癒や血管の修復時を除き、頻繫には認められない比較的まれなプロセスです。
血管の階層
発達した血管構造は、動脈(Artery)、細動脈(Arteriole)、毛細血管(Capillary、Blood Capillary)、細静脈(Venule)、静脈(Vein)で構成される血管の階層的ネットワークからなります(図1)。この血管網は身体全体へ血液を輸送する働きを担い、動脈が心臓から血液を運搬し、静脈が心臓へ血液を送り返します。動脈と静脈の間にある毛細血管床(Capillary Bed)は、ガスや栄養を交換するための場所であり、周辺組織へ定常的に酸素を供給し、栄養素や増殖因子の交換を適宜行います[2]。重要なことに、毛細血管システムは、肺へのCO2の輸送と除去だけではなく、腎臓や肝臓等の臓器への老廃物の輸送と除去も容易にします。リンパ管系(Lymphatic vascular system)も忘れてはならないネットワークです。リンパ管系とリンパ管(Lymphatic Vessel)は多くの場合免疫系に関連する一方、過剰な組織液(間質液、細胞間液、細胞間リンパ液とも呼ばれる)の除去と循環血液中への返還において極めて重要な役割を果たします[3]。
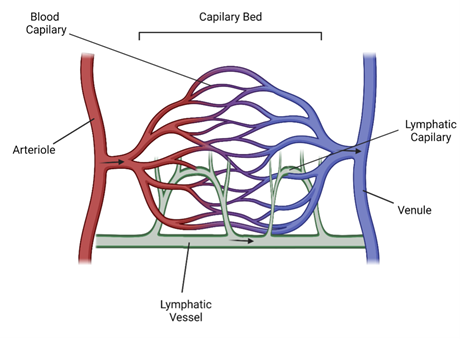
図1. 血管系の階層(Arteriole:細動脈、Blood Capillary:毛細血管、Capillary Bed:毛細血管床、Venule:細静脈、Lymphatic Vessel:リンパ管、Lymphatic Capillary:毛細リンパ管)
内皮細胞の機能
内皮細胞(EC:endothelial cell)は、血管内皮(vascular endothelium)を形成する重要な細胞であり、血管を裏打ちするように血管に沿って並びます。内皮細胞は、血管やリンパ管を覆う連続的な単一層を形成し、まるで「ファランクス(軍隊の密集陣形)」のような、非常に密集した石畳様の外観を呈するとしばしば表現されます(図2)。一見すると、内皮は血管内の内容物と身体の他の細胞との間に構造的障壁(バリア)を形成しているだけで、静的であるかのように見えるかもしれません。しかし、それは事実とは異なります。内皮を構成する内皮細胞は、血液と組織の両方が提供するシグナルを恒常的に受け取ることで、動的な挙動を示します[4]。内皮細胞が形成するバリアは、その微小環境や組織が提供する物質等に応じて調節を受け、非常に選択的に内皮を介した物質輸送を調整します。例えば、内皮細胞は免疫細胞の適切な動員および遊出を誘発し、侵入病原体に対する免疫応答を促進します[5]。それだけではなく、内皮細胞は、傷害を原因とする血管損傷等のネットワークの変化に対応できなければなりません。単層内の各内皮細胞は、損傷を受けると形態的な変化を促進し、血管新生や血管リモデリングを開始する能力を有しており、血管ネットワークによる組織への所要物質の供給の効率性を維持します[6]。完全に発達した成人の内皮細胞は、活発に増殖せずに静止状態にあるとみなされますが、絶えず細胞の周辺環境を感知し掌握し続けています。
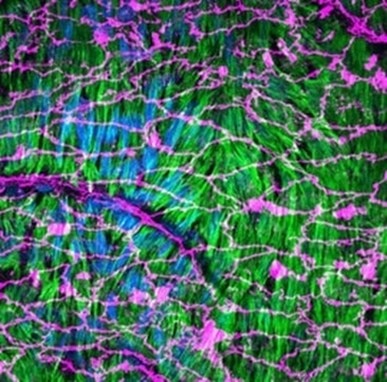
図2. Whole mount en face preparation法によるLifeact-EGFPマウス大動脈の免疫染色。接着結合(アドヘレンスジャンクション)マーカーとしてVE-Cadherin(内皮細胞、マゼンタ、使用抗体:VE-cadherin抗体(カタログ番号:66804-1-Ig))、核染色にHoechst(青)を使用した。Lifeact-EGFP(緑)によって平滑筋細胞のアクチン線維が内皮下部に位置していることが示されています(撮影:Florian Alonso博士、Bordeaux大学、仏)。
すべての内皮細胞が同じ挙動を示さないという点に留意することは非常に重要です。長年の研究により、動脈内部を覆う内皮細胞、静脈内部を覆う内皮細胞、リンパ管内部を覆う内皮細胞の挙動に大きな差異が認められることが明らかになっています。しかし、それだけではありません。ある1つの臓器の内皮細胞は、多くの場合、別の臓器内の内皮細胞と完全に異なる挙動を示します。このような事例はシングルセルRNA-seq解析によって明らかになり、異なる臓器の内皮細胞における遺伝子発現が顕著に異なることが判明しました[7]。発現遺伝子の相違は、腎臓の糸球体の透過性と比較して、血液脳関門(BBB、blood-brain barrier)が全く異なる非常に選択的な透過性を示す理由であると考えられています。以上のことから、内皮細胞が軍隊のように厳格かつ厳密に統制された挙動を示すという誤った認識を持ってはなりません。内皮細胞の外見上の構造がローマ軍の陣形に類似していたとしても、全体的な細胞の挙動は大きく異なります。
内皮機能障害と血管系疾患
血管系が身体の中で最も重要な役割を果たすシステムであると主張される理由は、血管系はほとんどすべての疾病に関与する、あるいは何らかの関連が認められる可能性があるためです。病態は血管系自体に生じる可能性があり、多くの場合、血管系疾患(vascular disease)と称されます。血管系疾患はしばしば、内皮細胞が正常な機能を喪失する内皮機能障害(endothelial dysfunction)によって助長されます[8]。内皮機能障害により、内皮細胞が異常な表現型へ変化する様々な病理学的プロセスが生じ、内皮細胞の表現型の変化と損傷によって最終的に内皮を介して栄養やガスを供給している組織が損傷します。内皮細胞が異常な機能を示し始める複数の原因が知られており、主な原因として、内皮に対するストレス要因が挙げられます。ストレス要因の具体例には、高血圧、糖尿病、高コレステロール血症、喫煙、感染症、加齢等があります[8]。しかし、これらのストレス要因によって機能障害に至る機構や、最終的に疾病の発症や悪化に至る仕組みといった、多くの解明されていない謎が残っています。
|
疾病 |
内皮細胞の挙動との関連 |
|
加齢性黄斑変性(AMR) |
血管が眼球のブルッフ膜を貫通し、網膜損傷および水分の滲出が生じる、脈絡毛細血管の異常な血管新生(脈絡膜血管新生)が生じます。 |
|
糖尿病網膜症(DR) |
高血糖による網膜血管の透過性の亢進と、異常な内皮細胞増殖が原因となり、網膜の損傷が生じます。 |
|
末梢動脈疾患 |
虚血が生じた際に、内皮細胞が虚血に対して適切な応答をすることができず、虚血性損傷後に側副血行路が適切に形成されません。 |
|
炎症性関節炎 |
内皮細胞のシグナル伝達により、免疫細胞を活性化し、その浸潤を促進します[8]。 |
|
腫瘍血管新生 |
内皮細胞が腫瘍の低酸素状態に応答することで、異常な血管形成が引き起こされます[9]。 |
|
腫瘍転移 |
内皮細胞が転移性腫瘍細胞の輸送を促進します[9]。 |
|
塞栓症、心筋梗塞、卒中、深部静脈塞栓症(DVT) |
内皮細胞が分泌する物質によって望ましくない血小板の活性化が生じ、血栓(凝血塊)が形成されます[8]。 |
血管系疾患の研究ツール
血管系や血管系を取り囲む内皮細胞の重要性等の解明は、科学研究の重要な焦点の1つとして進められています。心筋梗塞や失明、アルツハイマー型認知症や炎症性関節炎に至るまで、「慎ましく」存在しているようにみえる内皮細胞は、様々な疾患の発症や進行に大きく関与しています。腫瘍の成長や進行に関与する血管リモデリング等のすべての研究成果は、内皮細胞の機能障害と血管リモデリングが特に重要な研究対象となっている理由を示しています。
ヒト臍帯静脈内皮細胞(HUVEC:Human Umbilical Vein Vascular Endothelial Cell)やヒト皮膚リンパ管内皮細胞(HDLEC:Human Dermal Lymphatic Endothelial Cell)等、様々なin vivoモデルやin vitro実験に使用される初代細胞がこれまでに開発、販売されています。プロテインテックは、血管の発達や疾患における内皮機能障害を研究するラボに必要不可欠な、様々な抗体製品や組換えタンパク質を販売しています。
表1. プロテインテックが販売する血管系疾患や内皮細胞研究に関連する抗体、ELISAキット、組換えタンパク質、免疫組織化学(IHC)染色キット
IHCeasy:脱パラ・再水和後のサンプルに必要なすべての試薬が同梱された免疫組織化学キットです。各キットのプロトコールは、目的のタンパク質を染色するためにすべて最適化されています。
左:キット外観
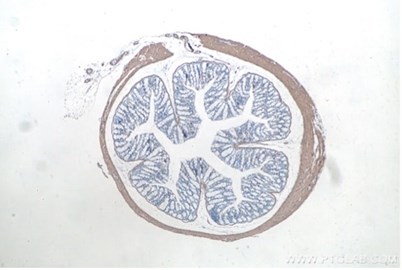
右:平滑筋アクチンIHCeasyキット(カタログ番号:KHC0053)を使用したパラフィン包埋マウス結腸組織スライドの免疫組織化学染色
参考文献
[1] P Carmeliet. Angiogenesis in health and disease. Nat Med. 2003 Jun;9(6):653-60.


