心臓科学の話題の中心
心臓研究における新たな課題
加齢は人生の必然であり、心血管疾患では、残念ながら最大のリスク因子となります。心臓は、必要とされる機能の変動に対応して、継続的なリモデリングを生じさせます。また、オートファジーは、細胞の恒常性に重要な役割を果たし、心筋の加齢による変化を反映します。サーチュイン(sirtuin)、AMP活性化プロテインキナーゼ(AMPK:AMP-activated protein kinase)、哺乳類ラパマイシン標的タンパク質(mTOR:mammalian target of rapamycin)、インスリン様成長因子(IGF-1:insulin-like growth factor 1)等の、正常な心血管系の制御に関与する複数の重要な遺伝子が関わります(図1)。
病的な血行動態の負荷過剰(例:高血圧、心筋梗塞)や負荷枯渇(例:長期間の床上安静、補助人工心臓)は、様々な種類の心血管疾患(CVD:cardiovascular diseases)を誘発します。2012年に、世界保健機関(WHO)は、世界の死因の30%超はCVD(主な死因は冠動脈性心疾患・脳卒中)によるものと報告しています。心血管疾患の最も一般的な要因には、喫煙、慢性的ストレス、高血圧、糖尿病等が挙げられます。
プロテインテックは、心臓とそのメカニズムの研究に役立つ製品を提供しています。
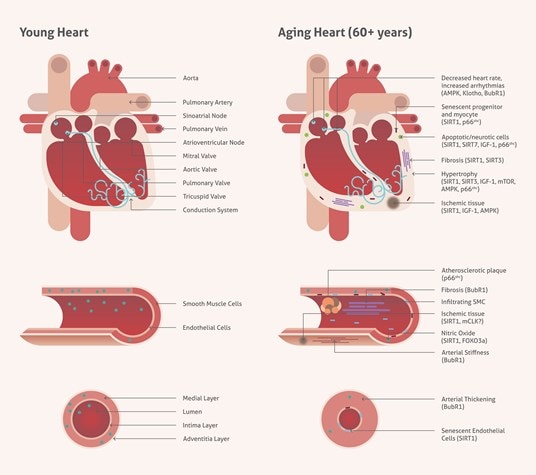
図1. 心血管組織の加齢に伴う変化
高血圧に関連する新たな遺伝子領域
最新の発見の1つに、高血圧に関連する新たな遺伝子群の発見があります(1)。高血圧は、世界的に心臓病、脳卒中、それらによる死亡の主要な原因です。高血圧に寄与する主な因子は、遺伝的因子、そして、食事、体重、アルコール摂取、運動等のライフスタイル因子です。研究グループは、心血管組織や血管で高い発現を示す107の遺伝子によって高リスク患者を特定できる可能性を見出しました。研究グループは、42万名の英国バイオバンク登録者の980万超の遺伝子バリアントを解析し、その解析結果と被験者の血圧データを相互参照しました。遺伝子検査を利用することにより、医師は個々の患者にあわせて適切な治療を施すことが可能になります。
iPSC由来の心筋細胞とそのマーカーパネル
ヒトiPSC(人工多能性幹細胞)由来の心筋細胞は、研究者によるヒト細胞モデルの構築を成功させ、それらの分野の研究を促進しました。in vitro研究モデルとしてのiPSC由来の心筋細胞は、初代細胞と比べて大きな利点があります。なぜならiPSC由来の心筋細胞は、複数の実験セットを実施する場合、同一の遺伝的背景を持つ心筋細胞の継続的な供給源になるからです。iPSC心筋細胞は、心毒性試験、薬剤スクリーニング、薬剤の作用検証、電気生理学的用途のための優れたツールです。多くのiPSC由来心筋細胞in vitroモデルは、自発的な細胞拍動を示し、心臓特異的マーカーパネル(心筋トロポニン(cardiac troponin)、ANKRD1等)によって目的の細胞であると定義づけることができます。心筋損傷を識別する際の、血清中の心筋トロポニンI(Cardiac troponin I)、心筋トロポニンT(Cardiac troponin T)濃度の測定は、心筋由来酵素(クレアチンキナーゼ)を測定するよりも感度および特異度に優れています。現在では、心筋トロポニン濃度は心筋梗塞を診断する標準的な生化学マーカーとして使用が認められています(2)。
幹細胞由来の成熟心筋細胞
研究者は既にヒト幹細胞や動物幹細胞から成熟し機能を維持した心筋の作製を実現し、新生仔への培養心筋の移植に成功しています(3)。細胞培養用ディッシュで培養した幹細胞は、成熟に必要な遺伝子発現を開始することができませんが、生体内で幹細胞を成長させると成熟した心筋細胞へ分化できるようになります。この場合、宿主動物の心臓は、移植された未成熟な心筋細胞が必要とする生物学的シグナルや化学物質を供給して分化を促し、通例、実験的条件で細胞の成長を停止させてしまっていた増殖の障壁を克服します。
組織工学の進歩と心臓再生
心筋梗塞発生後、心臓は筋肉組織を再生できないため、筋層の一部が死滅します。死亡組織は周囲の筋肉に負担をかけ、致命的な心臓肥大を引き起こす場合があります。研究グループらは、3Dプリンターで作成した1µmレベルの解像度の足場に、ヒト細胞の混合物を播種することによって心組織に成長させる実験に成功しています(4)。細胞は足場内で自己組織化して人工心組織を生成し、播種から1日以内に拍動を開始し、翌週には収縮の速度と強度が有意に増加しました(5)。また、ヒト由来の心筋パッチを心筋梗塞後のマウスの心臓に外科的に留置すると、心機能が有意に改善し、死亡組織のサイズが減少しました。
新たな科学的発見により、心疾患と心臓修復のモデル構築の現状をさらに向上させることができると期待されます。今後の課題は、これらの発見を新たな患者の治療法に適用することです。
参考文献
- H R Warren, et al. Genome-wide association analysis identifies novel blood pressure loci and offers biological insights into cardiovascular risk. Nat Genet. 2017 Mar;49(3):403-415.
- P O Collinson, et al. Measurement of cardiac troponins. Ann Clin Biochem. 2001 Sep;38(Pt 5):423-49.
- G-S Cho, et al. Neonatal Transplantation Confers Maturation of PSC-Derived Cardiomyocytes Conducive to Modeling Cardiomyopathy. Cell Rep. 2017 Jan 10;18(2):571-582.
- A V Borovjagin, et al, From Microscale Devices to 3D Printing: Advances in Fabrication of 3D Cardiovascular Tissues. Circ Res. 2017 Jan 6;120(1):150-165.
- L Gao, et al. Myocardial Tissue Engineering With Cells Derived From Human-Induced Pluripotent Stem Cells and a Native-Like, High-Resolution, 3-Dimensionally Printed Scaffold. Circ Res. 2017 Apr 14;120(8):1318-1325.

