特集:PD-1/PD-L1パスウェイ
免疫システムで注目のPD-1/PD-L1シグナル伝達経路について解説します。
| - はじめに | - PD-1/CD279抗体 |
| - 免疫療法:がんの有望な治療法 | - 関連製品 |
| - ELISAキット | - 参考文献 |
はじめに
免疫系とは、病原体を認識して攻撃/排除する生体防御機構です。しかし、免疫系が過剰反応を引き起こした場合、この防御機構自体が疾患を引き起こす可能性があり、例えば全身性エリテマトーデス(SLE)や多発性硬化症(MS)等の自己免疫疾患の原因となり得ます。反面、身体は必要に応じて免疫系を抑制する様々なメカニズムを発達させてきました。
PD-1経路は免疫抑制機構の1つとして挙げられます。PD-1経路は免疫系細胞の動員に応答して活性化されます。PD-1は活性化されたT細胞等のリンパ球細胞表面に発現し、PD-1のリガンドであるPD-L1はサイトカインを介したシグナル伝達に応答して抗原提示細胞等で誘導・発現されます。PD-L1がPD-1と結合すると、T細胞等の免疫細胞活性化に関与する下流のシグナル伝達分子のリン酸化が阻害され、サイトカイン産生やT細胞の活性化が抑制されます[1、2]。
| 抗体名 | カタログ番号 | 抗体タイプ | アプリケーション |
| PD-1/CD279 | 18106-1-AP | ウサギポリクローナル | ELISA, IP, CoIP, IHC, IF, FC |
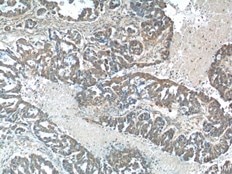 |
PD-1/CD279抗体(カタログ番号:18106-1-AP、希釈倍率1:800)を用いた、ヒト扁桃炎組織(パラフィン包埋切片、Tris-EDTAバッファー(pH9)で加熱抗原賦活処理)の免疫組織化学染色(10X)。 |
免疫療法:がんの有望な治療法
腫瘍細胞は、PD-1経路等を利用して宿主の免疫監視機構を回避することが知られています[3]。そのため、多くの製薬企業がPD-1やPD-L1を阻害する抗体医薬品を開発しています。臨床試験では、多くの患者において抗PD-1抗体や抗PD-L1抗体による高い治療効果が認められています[4-8]。これらの抗体医薬品が特に有効性を発揮するには、腫瘍部位に多数のCD8+T細胞が既に存在し、PD-1経路の阻害後にCD8+T細胞が動員される準備が整っていなければなりません[9]。近年の研究では、PD-1阻害薬の有効性を高める有望な手法が研究されています。1つは、HDAC阻害剤[10]や抗CTLA4抗体[7]のような別の薬剤をPD-1阻害薬と併用する手法です。その他の手法は、治療効果予測にバイオマーカーを用いる手法です[11、12]。また、近年の研究ではGSK3阻害剤が免疫療法の治療効果を高める可能性があることが示唆されています[13]。これらの結果は有望ではありますが、抗体医薬品による治療には自己免疫作用の軽減や薬剤耐性の克服法等のいくつかの難題が残っています。
抗体医薬品の開発状況
| 候補薬 | 開発企業 | |
| PD-1 | Camrelizumab(SHR-1210) | Jiangsu Hengrui Medicine/Incyte |
| Nivolumab(ニボルマブ) | Bristol-Myers Squibb | |
| Pembrolizumab(ペンブロリズマブ) | Merck | |
| Pidilizumab(CT-011) | CureTech | |
| BMS 936559 | Bristol-Myers Squibb | |
| PD-L1 | Atezolizumab(アテゾリズマブ) | Roche |
| Durvalumab(デュルバルマブ) | AstraZeneca | |
| Avelumab(アベルマブ) | Pfizer/Merck | |
| MDX-1105 | Bristol-Myers Squibb | |
| CTLA-4 | Ipilimumab(イピリムマブ) | Bristol-Myers Squibb |
| Tremelimumab(トレメリムマブ) | Pfizer/AstraZeneca |
PD-L1/CD274抗体
| 抗体タイプ:ウサギポリクローナル | KD/KO 検証済み |
| カタログ番号:17952-1-AP | 使用文献:153文献 |
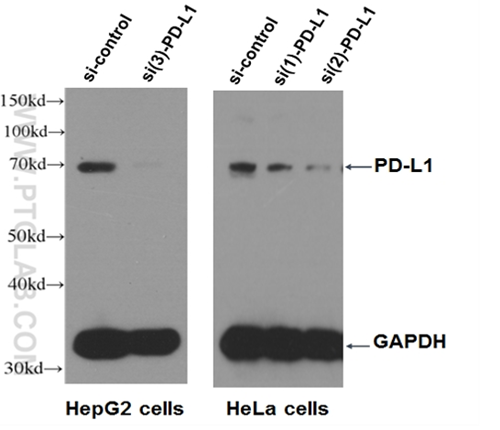 |
|
PD-L1抗体(カタログ番号:17952-1-AP、希釈倍率1:500)を使用した、si-PD-L1トランスフェクションHepG2細胞およびHeLa細胞のウェスタンブロット(WB)。3種類のノックダウンサンプルは、個別にトランスフェクションを実施した。 |
関連製品
| 抗体名 | カタログ番号 | 抗体タイプ | アプリケーション |
| PD-L1/CD274 | 66248-1-Ig | マウスモノクローナル | ELISA, WB, IHC, IF, IP, CoIP, FC |
| CD86 | 13395-1-AP | ウサギポリクローナル | ELISA, WB, IF, FC, Cell treatment |
| CD3 epsilon | 17617-1-AP | ウサギポリクローナル | ELISA, WB, IHC, IF, IP, FC, Cell treatment |
| GSK3B | 22104-1-AP | ウサギポリクローナル | ELISA, WB, IHC, IF, IP, CoIP, RIP |
| BRAF | 20899-1-AP | ウサギポリクローナル | ELISA, WB, IHC, IF |
ローディングコントロール抗体
| GAPDH抗体 |
|
Beta Actin抗体(KD/KO 検証済) | 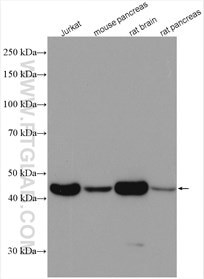 |
| カタログ番号:60004-1-Ig | カタログ番号:66009-1-Ig | ||
|
GAPDHは、広い細胞種で高く発現するため、ウェスタンブロット実験におけるタンパク質ローディングコントロールとして頻繁に使用されます。GAPDHは、解糖、DNA修復、アポトーシス等、いくつかの細胞機能にも関わることが知られています。 |
βアクチンは、全ての真核細胞タイプにわたって広範で一貫した発現を示し、また、このタンパク質の発現レベルはほとんどの実験的処理に影響を受けないことから、通常、ローディングコントロールとして用いられます。 |
ELISAキット
Human PD-L1 ELISA Kit |
|
カタログ番号:KE00074 |
|
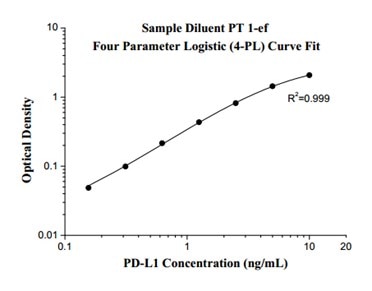
| プロテインテックのヒトPD-L1測定ELISAキットは、内在性PD-L1のタンパク質レベルを定量的に検出・測定できるELISAキット(サンドイッチ法)です。 | |
 |
 |
| フォーマット | 測定可能動物種 |
| 1 X 96 well plate | ヒト |
| 測定可能なサンプル | 感度 |
| 血清、血漿、細胞培養上清、細胞ライセート | 0.04 ng/mL |
| 測定範囲 | アッセイ方法 |
| 0.156 ng/mL-10 ng/mL | サンドイッチELISA |
Human PD-1 ELISA Kit |
|
カタログ番号:KE00075 |
|
|
プロテインテックのヒトPD-1測定ELISAキットは、内在性PD-1のタンパク質レベルを定量的に検出・測定できるELISAキット(サンドイッチ法)です。 |
|
 |
|
| フォーマット | 測定可能動物種 |
| 1 X 96 well plate | ヒト |
| 測定可能なサンプル | 感度 |
| 血清、血漿、細胞培養上清、細胞ライセート | 43 pg/mL |
| 範囲 | アッセイ方法 |
| 125 pg/mL-8000 pg/mL | サンドイッチELISA |
参考文献
2. J B.A.G. Haanen. Immunotherapy of melanoma. EJC Suppl. 2013 Sep;11(2):97-105.


