特集 : FGF BASIC TS
熱安定性FGFは週末の培地交換が不要です。
FGF basicの基本背景
FGF basic(Basic fibroblast growth factor、塩基性線維芽細胞成長因子)は、bFGF、FGF2、FGF-β、またはHBGF-2とも呼ばれ、FGFファミリーに属します。
- FGFは、in vivoおよびin vitroで多様な生物学的機能に関わる重要な役割を果たします。
- FGFは、胚発生、ニューロン分化、中胚葉由来の細胞、神経外胚葉、外胚葉、および内胚葉由来の細胞の多くの増殖に関与しています1,2。
プロテインテックは、熱安定性 FGF(FGFbasic-TS:thermostable)を開発しました。
| アニマルフリー組換えヒト FGFBasic-TS | |
|
カタログ番号: HZ-1285 - HEK293 発現 |
- アニマルコンポーネントフリー - エンドトキシンフリー |
FGFは、細胞を未分化状態に維持するための、幹細胞培養培地の必須成分です。FGFは不安定であるため、培地交換を毎日行う必要があります。
プロテインテックは、2日ごとの培地交換スケジュールに対応する熱安定性FGF塩基性(FGFbasic-TS)を開発し、これにより、週末中の培地交換が不要になりました(図1)。
| 図1 | |
 |
 |
|
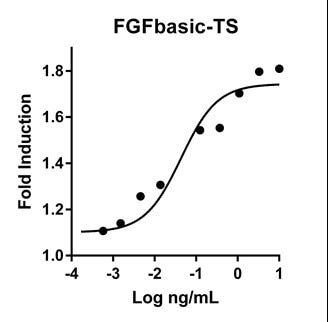
FGFbasic-TSの活性は、Promega CellTiter96®水溶性非放射性細胞増殖アッセイを使用して、Balb/c 3T3細胞株の用量依存的増殖刺激によって測定した。 |
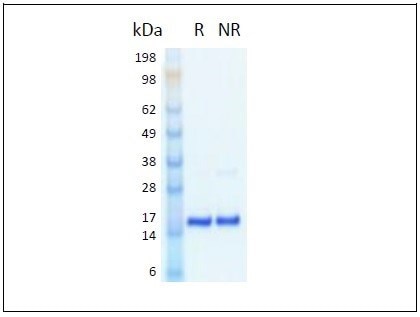
FGFbasic-TSは、SDS-PAGE分離後にクマシーブルーで染色した。(R)は還元条件を示し、(NR)は非還元条件を示す。 |
プロテインテックのFGFbasic-TSは、アニマルフリーの成分を使用して、HEK293細胞で作製されています。
FGF塩基性は幹細胞培養に不可欠です3。現在バイオ医薬品市場で提供されているものは細菌や動物細胞を使用して作製されており、これらは病原体伝播のリスクを増大させます。
- FGFbasic-TSは、その生物学的機能を変化させることなく、培地中での安定性を高めるように操作されました。
- 17 kDaの非グリコシル化モノマーサイトカインである154アミノ酸は、信頼できるヒト組換えタンパク質の産生用に開発されたプロテインテック社独自のヒト細胞株(HEK293)で発現されます
- FGFbasic-TSは、大腸菌由来のFGF塩基性よりも安定性が高く、37℃での持続時間は3倍です(図2)。
| 図2 | |
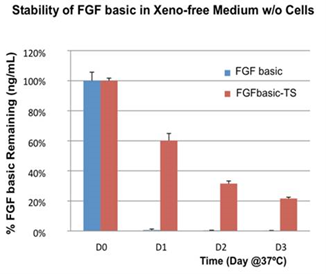 |
ゼノフリー(異種フリー)の既知組成細胞培養培地におけるFGFbasic-TSとFGF basic(大腸菌由来)の37℃での安定性。タンパク質濃度は、ELISAによって3日間毎日測定した。37℃で1日インキュベートした後、FGF basicは検出不能であったが、FGFbasic-TSは1、2、3日目に、それぞれ開始濃度の60%、35%、20%が存在していた。 |
FGFbasic-TSの生化学的・細胞培養分析
多能性マーカー:SSEA-1、Tra 1-60、Tra1-81、Oct3/4
- 分子マーカーは、継代時の発現によって多能性幹細胞の状態を調べる方法の1つです。
- FGFbasic-TSは、ヒト胚性幹細胞(hESC)とヒト人工多能性幹細胞(iPSC)において、2日間のフィーディングスケジュールを使った多能性マーカーの効果的な維持について評価されました。
プロトコル概要:
- FGFbasic-TSを10 ng/mLの割合で添加する。
- ヒト細胞株を、異種フリー、既知組成マトリックス(XFM)またはマトリゲル(MG)を含む、異種フリー、既知組成培地で培養する。
- 細胞の継代には、異種フリーの非酵素的継代溶液(XFPS)またはコラーゲンベースの試薬(CG)を使用する。
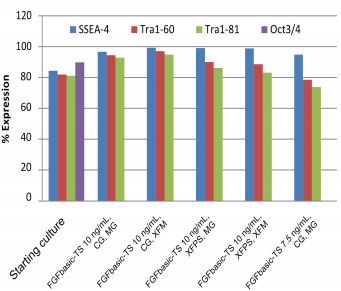
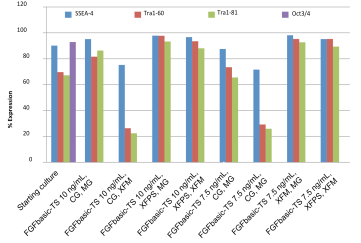
- 多能性細胞表面マーカーを、すべての培養条件について、7.5または10 ng/mLのFGFbasic-TSを含む培地で増殖させたhESCとiPSCの、培養開始時と10回目の分割後の培養液のフローサイトメトリーによって分析する(図3および4)。
<td図3 <td図4
 |
 |
|
熱安定性FGF塩基性で維持されたhESC培養物中の、スターターの培養時と10継代後の多能性マーカー。 |
熱安定性FGF塩基性で維持されたiPSC培養物中の、スターター培養時と10継代後の多能性マーカー。 |
酵素消化抵抗性
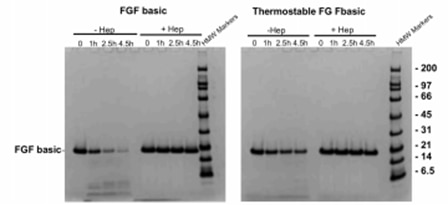
トリプシンによる分解に対して安定化するためにヘパリンを添加して、またはヘパリンを添加せずにFGF basicとFGFbasic-TSをトリプシン消化に付した後、SDS-PAGEゲル上で分析しました。
- FGF basicは4.5時間後に有意に分解されていましたが、FGFbasic-TSのタンパク質レベルはわずかに減少しただけでした(図5)。
- FGFbasic-TSは、細胞培地中での安定性とタンパク質分解に対する抵抗性が、FGF basicと比べて優れていました。
| 図5 |
 |
|
図5.FGF basicとFGFbasic-TSのトリプシン消化。HMWタンパク質標準と、FGF塩基性またはFGFbasic-TSを、4~12%Nu-PAGE Bis-Trisゲルにロードした。ゲルは非還元条件下で電気泳動させた。 |
プロテインテックのFGFbasic-TS HZ1285は、2日間のフィーディングスケジュールで細胞増殖、多能性、および分化能を維持します。
- 幅広い幹細胞培養に応用可能―成熟エフェクター型細胞に分化する前の多能性または少能性細胞型、ならびに間葉系幹細胞(MSC)、神経幹細胞(NSC)、および造血幹細胞(HSC)に使用可能です。
- 熱安定性―培養細胞をより効率的かつ均一に維持します。
- 高い費用対効果―細胞培養に要する培地交換の頻度を低減します。
- 高い生物活性―37℃で2〜3日以上生物活性を保持することができます。
関連資料
- Benefits of HumanKine® recombinant proteins for clinical applications
- New GMP laboratory to focus on HumanKine® line of human cell line-derived growth factors and cytokines for use in the pharmaceutical industry
- Proteintech announces an agreement to acquire HumanZyme, a leading manufacturer of recombinant human proteins
- Proteintech's recombinant proteins product line
- HumanKine® Cytokines and Growth Factors
- Human serum albumin’s importance in biology and biotech
- Recombinant human protein Activin A: An Alpha in the TGF Beta Family
- GM-CSF – A modulatory cytokine in autoimmunity & inflammation
参考文献
- Stemple D, Mahanthappa N, Anderson D. Basic FGF induces neuronal differentiation, cell division, and NGF dependence in chromaffin cells: A sequence of events in sympathetic development. Neuron. 1988;1(6):517-525.
- Rydel R, Greene L. Acidic and basic fibroblast growth factors promote stable neurite outgrowth and neuronal differentiation in cultures of PC12 cells. The Journal of Neuroscience. 1987;7(11):3639-3653.
- Xu R, Peck R, Li D, Feng X, Ludwig T, Thomson J. Basic FGF and suppression of BMP signaling sustain undifferentiated proliferation of human ES cells. Nature Methods. 2005;2(3):185-190.
- Pera M. Stem cell culture, one step at a time. Nature Methods. 2005;2(3):164-165.


