ゲスト寄稿 | 細胞成分を分画するための8つのヒント
細胞成分の分画を成功させるための8つの技術的ヒントを解説します。
Alex Ryan著
細胞成分分画とは、細胞を様々な細胞小器官(オルガネラ)に分離する手法です。高濃度のショ糖を使用し、その密度に基づいて細胞画分を分離します。単離した単一の細胞小器官を調べたい場合に有用な方法で、細胞フリーの条件下でその他の細胞内成分の干渉を受けることなくプロセスを研究することができます。
細胞成分の分画を成功させるための私からのヒントを紹介します。
1. 目的のタンパク質を知る
まず、最も重要なことは、実験の目的タンパク質を知ることです。この話は何度か出てきます。繰り返し言及するので忘れても大丈夫です。目的タンパク質の知識が最初に役に立つのは、そもそも分画処理が必要かどうか判断する時です。分画を行う理由はいくつもあります。タンパク質輸送、膜動員や細胞膜への隔離を調べたい場合や、上述した通り、他の細胞機能の干渉がない状態で単一のプロセスを調査したい場合もあります。タンパク質の単離だけであれば、代わりに免疫沈降法のような方法を検討してみましょう。
分画実験を計画する際に目的のタンパク質について最初に知っておくべきことは、タンパク質の予想される存在場所です。分画法には様々な種類があり(詳細は後述します)、どの種類を選択するかは、タンパク質の予想される局在や得られたタンパク質でどのような実験を実施するかによって異なります。また、目的タンパク質の持つ機能も分画法の選択にあたり重要な要素であるため、目的タンパク質の特性を知っておく必要があります。膜貫通型タンパク質を精製する場合、まったく予測できないと言わざるを得ません。個人的な経験から述べると、インスリン応答性グルコーストランスポーターGLUT4は非常に厄介なタンパク質でした。
2. 方法を賢く選択する
目的のタンパク質を知ることで、分画手法を取捨選択できます(上記参照)。分画手法は何種類かあり、得られる画分も異なります。どの方法を選択するかは、目的タンパク質の知見と目的タンパク質を使用して何を実施するか次第です。非常に単純な細胞成分分画法の場合、粗精製の膜画分のみを得ることができます[1]。この方法を使用すると、核画分、単一の膜画分、非常に希薄な細胞質画分の3つの画分が得られます。細胞を低張緩衝液で膨潤させると、核が分離します。上清を比較的低濃度のスクロース(0.33M前後)中で遠心分離すると、膜ペレットと細胞質上清が得られます。
Waliら[1]が報告しているように、ホモジナイズ緩衝液からTriton X-100を除去することは、膜に存在している状態のタンパク質活性を調べたい場合、特に目的タンパク質が活性化時に膜に動員される場合(例:ホスホリパーゼC)、理想的な方法です。また、この方法を用いると、ウェスタンブロット解析に最適なサンプルが得られます。細胞質画分をさらに遠心分離すすることによって、個々の細胞小器官を得ることができます[2]。
より精密に分画したい場合は、さらに高濃度のスクロース溶液(1.2M)を使用して、数回に分けて遠心分離を実施します[3]。この時、高密度の脂質画分(例:粗面小胞体)と、低密度の脂質画分(例:滑面小胞体、ゴルジ体、小胞体)が得られます。遠心分離の条件に応じて、個々の細胞小器官を単離することが可能です[4]。細胞全体に及ぶ細胞内輸送を調べたい場合、こうした画分でウェスタンブロットを実施すると良い結果が得られます。
3. 溶解バッファーvs膨潤バッファー
既にお気づきかもしれませんが、低張膨潤バッファーは、細胞膜の細胞成分分画で重要な役割を果たします。通常、溶解バッファー(Lysis Buffer)にはSDS等の界面活性剤や、細胞を破壊するための酸が含まれています。界面活性剤によって、膜中の脂質は無秩序な状態になり、実質的な膜の消滅が引き起こされます。一方、膨潤バッファーは、浸透圧によって細胞を穏やかに「破裂」させる低張溶液です。膜の完全性が重要な意味を持つ実験の場合、溶解バッファーは使用しないことをおすすめします。
4. タンパク質の活性を調べていますか?
タンパク質の活性を研究する場合、タンパク質の活性が全く損なわれていないことが非常に重要となるため、分画法の検討は重要事項です。多くの緩衝液には、ホスファターゼ阻害剤、EDTAまたはEGTA、界面活性剤等が含まれており、これらはすべてタンパク質の正常な機能を妨げます。ウェスタンブロットを使用して画分を解析する場合は、タンパク質の機能が損なわれて変性していても問題はありませんが、細胞プロセスを生化学的に調べる場合は、すべてのタンパク質が正しい機能を維持していなければなりません—そのため、余分な物質の添加は避けましょう。
5. 画分を知る
個々の画分、または個々の細胞小器官についてウェスタンブロットを実施する場合、正しい細胞小器官の画分を調べているかを確認することが重要です。都合の良いことに、プロテインテックをはじめとする抗体を販売する企業は、細胞小器官や分画後の画分に特異的なコントロール抗体を多数取り揃えています(下記の表をご参照ください)。コントロール抗体を使用することで、単離された細胞成分が目的の成分であるか検証することができます。分画した画分の中には検証に手間を要する画分もあります(例:細胞膜画分)。そのような場合は、陽性マーカーと陰性マーカーの両方のパネルを使用した純度評価の実施を検討してください。
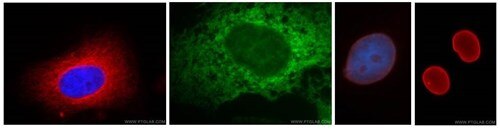
抗体はウェスタンブロットによる画分の検証に役立ちます。本画像はプロテインテックが販売する抗体を使用した免疫蛍光染色イメージングによって得られた種々の細胞小器官の可視化像です。プロテインテックの抗体はウェスタンブロットに供した画分のローディングプローブとしての使用にも適しています。(左端から) Hela細胞:抗αチューブリン(赤)で染色。A431細胞の小胞体(ER):抗カルネキシン(緑)で染色。HepG2細胞の核エンベロープ:抗ラミンA/C(左から3番目)(赤)および抗ラミンB1(右端)で染色(赤)。
6. Igepal CA-630はあなたの味方!
Igepal CA-630を使用すると、膜貫通タンパク質の分解を防ぐことができます。ウェスタンブロットで膜貫通タンパク質を検出できない場合、0.1%(v/v)程度のIgepal CA-630を添加すると良い結果を得られる可能性があります。
7. 事前に計画を立てる
細胞成分の分画には多くの時間を要します。上述したGLUT4の場合、その実験は3人がかりの作業でした。朝の7時半頃に職場に到着した私の上司がサンプルの刺激処理を実施します。私は8時半に到着してから、分画とタンパク質アッセイを実施して、ウェスタンブロット用のサンプルを調製します。午後5時頃に、60℃で30分間ボイルしたサンプルを、さらにもう1人の博士課程の学生に引き継ぐと、彼はただちにゲル電気泳動と転写作業を実施するのです。つまり、実験全体におおよそ14時間を要し、かつ、この時間はウェスタンブロットの実験結果の解析作業を除いた時間でした。
また、すべての画分は可能な限り氷上に置き、使用するすべてのバッファーを氷冷することも重要です。さらに、超遠心分離機は冷却に時間がかかることがあるので、早めに電源を入れておきましょう。目覚まし時計をセットして、同僚と良好な関係を築いておくことも重要かもしれません。
8. 目的のタンパク質を知る
冒頭で繰り返し述べるとお伝えしましたが、自分の取り扱うタンパク質を知ることは重要です。
関連抗体
| 細胞小器官 | カタログ番号 | ターゲット |
| 細胞骨格(Cytoskeleton) | 66031-1-IG | α tubulin |
| 細胞骨格(Cytoskeleton) | HRP-66031 (HRP-conjugated) | α tubulin |
| 細胞骨格(Cytoskeleton) | 20536-1-AP / 60008-1-Ig | β actin |
| 細胞骨格(Cytoskeleton) | HRP-60008 (HRP-conjugated) | β actin |
| 小胞体(Endoplasmic reticulum) | 10427-2-AP | Calnexin |
| 小胞体(Endoplasmic reticulum) | 11587-1-AP | GRP78 / HSPA5 |
| ゴルジ体(Golgi) | 11308-1-AP | GM130 |
| ゴルジ体(Golgi) | 12255-1-AP / 66170-1-Ig | RCAS1 / EBAG9 |
| 膜(Membranes) | 20874-1-AP | E-Cadherin |
| 膜(Membranes) | 14418-1-AP | Na+/K+ ATPase |
| 膜(Membranes) | 17435-1-AP / 66171-1-Ig | Transferrin |
| ミトコンドリア(Mitochondrion) | 11242-1-AP | COX IV 1 |
| ミトコンドリア(Mitochondrion) | 10866-1-AP | VDAC1 / Porin |
| 核膜(Nuclear envelope) | 10298-1-AP | lamin A/C |
| 核膜(Nuclear envelope) | 12987-1-AP | Lamin B1 |
| 核(Nucleus) | 20813-1-AP | LSD1 / KDM1 |
| 核(Nucleus) | 11231-1-AP | SETDB1 / ESET |
参考文献

