実験設計におけるエピトープ選択の重要性
正確な抗体結合部位の把握は、研究・診断・治療の成果を確実に向上させます。
抗体実験を計画する際に見過ごされやすい重要なポイントの1つは、研究対象のタンパク質上に存在する、抗体結合部位(「エピトープ」)に関する正確な情報です。研究用抗体試薬は、「抗体」の主な特性である特定のタンパク質(抗原または免疫原)に対して強く結合するという性質を利用しており、この働きによってタンパク質の検出・中和・タンパク質活性の制御が可能になります。結合するエピトープ領域に基づいて戦略的に抗体を選択することで、実験結果、創薬戦略・治療戦略、診断の精度は大きく変化します。本稿では、抗体とエピトープの結合に関する理解が、実験の設計、成否、そして結果の解釈に重要となる9つの具体的観点を紹介します。
1. 立体構造(コンホメーション)エピトープ vs 線形(リニア)エピトープの選択
線形エピトープ(リニア/一次構造エピトープ)に結合する抗体は、変性および還元したサンプルを用いるウェスタンブロット(WB)では機能しやすい一方、タンパク質が完全な立体構造を維持した組織切片サンプルを用いる免疫組織化学(IHC)では機能しない場合があります。抗体を適用するアプリケーションによって、目的タンパク質の検出を成功させるための抗体およびエピトープ選びの条件は異なる可能性があります。ELISAのようなアッセイの場合、立体構造エピトープまたは線形エピトープのどちらを認識する抗体を必要とするかは、測定サンプルの種類や調製方法によっても異なります。主に非変性条件で行う免疫沈降(IP)や共免疫沈降(Co-IP)実験等では、線形エピトープだけではなく、立体構造エピトープも認識されることが多くあります。
2. 翻訳後修飾の検出
エピトープ内または近傍にリン酸化、グリコシル化、アセチル化等の修飾を受けるアミノ酸残基が存在する場合、これらの翻訳後修飾の有無によって抗体とエピトープの結合が変化し、実験結果に影響を及ぼす可能性があります。そのような事例とは別に、特定の領域のリン酸化修飾といった、翻訳後修飾が施された部位に選択的に結合する抗体が必要となる場合もあります。
プロテインテックの関連製品:リン酸化修飾抗体

図1. HEK-293細胞をSDS-PAGE後、Phospho-AKT(Ser473)抗体(カタログ番号:80455-1-RR、希釈倍率1:10000)を使用し、室温で1.5時間インキュベーションしたウェスタンブロット。Phospho-AKT(Ser473)を検出後、メンブレンをストリッピング(抗体除去)し、ローディングコントロールとしてGAPDH抗体をリプローブした。左レーン:(-)未処理細胞ライセート、右レーン:(+)Calyculin A処理細胞ライセート。
3. アイソフォームの識別
タンパク質のアイソフォームに特異的なエピトープを認識する抗体は、類似性が高いタンパク質を識別する際に役立ちます。その一例が、細胞代謝において異なる役割を果たすピルビン酸キナーゼ(PKM)の2つのアイソフォーム(スプライシングバリアント)、PKM1とPKM2を識別する抗体です。PKM1は筋細胞や神経細胞に発現が認められ、PKM2はがん細胞や急速に増殖する組織に認められます。PKM1は効率的なエネルギー産生において重要な役割を担う酵素ですが、PKM2はがんにおける代謝経路のリプログラミング(ワールブルグ効果)に関連があるとされています。このように、機能が異なるアイソフォームを正確に解析するためには、それぞれに特異的に結合する抗体が不可欠です。
プロテインテックの関連製品:PKM1抗体&PKM2抗体

図2. マウス骨格筋組織ライセートをSDS-PAGE後、PKM1-specific抗体(カタログ番号:15821-1-AP、希釈倍率1:2000)を使用し、室温で1.5時間インキュベーションしたウェスタンブロット。
4. 立体障害と干渉の回避
フローサイトメトリー(FC)やマスサイトメトリー(MC)のような、複数の抗体を使用して異なるタンパク質や、同一タンパク質の異なるドメイン等を同時に検出するマルチプレックスアッセイでは、抗体同士の干渉や交差反応性を回避するためにエピトープ情報をあらかじめ把握しておくことが重要です。各ターゲットタンパク質に特異的な抗体を選択することで、各抗体が特異的に各ターゲットへ結合し、より明確で精度の高いデータの取得が可能になります。また、フローサイトメトリーでは、細胞の活性化に伴い発現する特定のマーカー(活性化マーカー)や、活性化状態に特異的なエピトープの検出が有用となる場合があります。同一タンパク質を標的とする場合であれば、良好な結果を得るためには、重複しないエピトープをターゲットとした抗体の使用が重要です。
抗体が認識するエピトープがタンパク質複合体の内部に埋もれていて、立体構造の表面に露出していない場合、そのエピトープをターゲットとする抗体は共免疫沈降やプルダウンアッセイで効果的に機能しない可能性があります。まずは免疫沈降や共免疫沈降で十分に検証された抗体を選ぶことをおすすめしますが、抗体の結合領域に関する情報を把握しておくことで、抗体が目的の実験に適しているか否かを判断するための参考になります。
5. タンパク質フォールディングおよび細胞局在による抗体アクセスの制約の把握
エピトープが、フォールディングされたタンパク質の内部に埋没し、表面に露出していない場合、エピトープにアクセスできず、抗体が結合できない場合があります。これは特に、フローサイトメトリーやライブセルイメージング等の固定・透過・賦活化処理を行わない生細胞ベースのアプリケーションにおいて問題となることがあります。また、膜貫通タンパク質を標的とする場合、抗体のエピトープが細胞内/細胞外のどちらのドメインに結合するのかを実験計画の段階で把握しておくことが重要です。細胞外ドメインを標的とする場合には、固定や透過処理は不要ですが、細胞内ドメインにエピトープが存在する場合には固定処理や透過処理が必要になります。
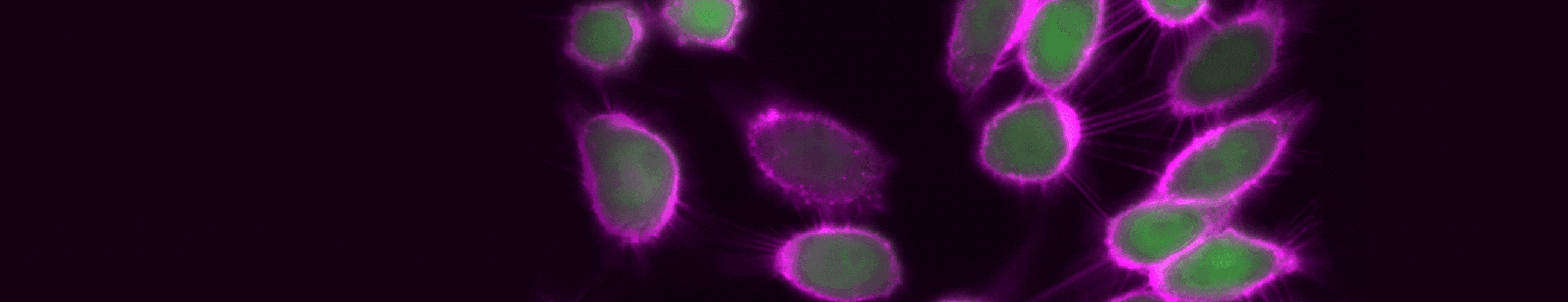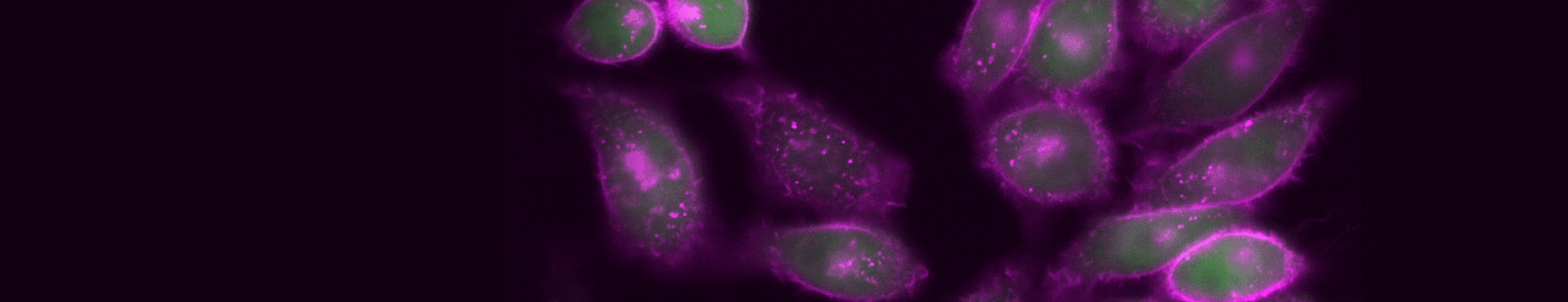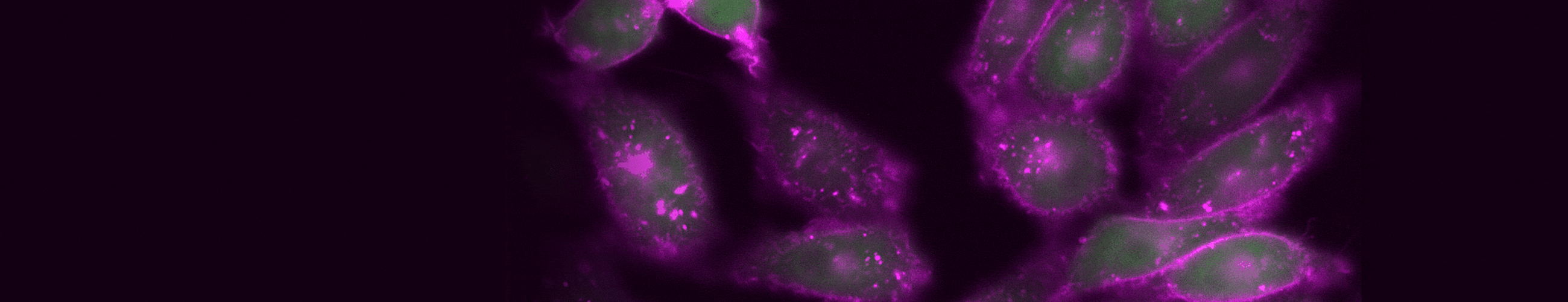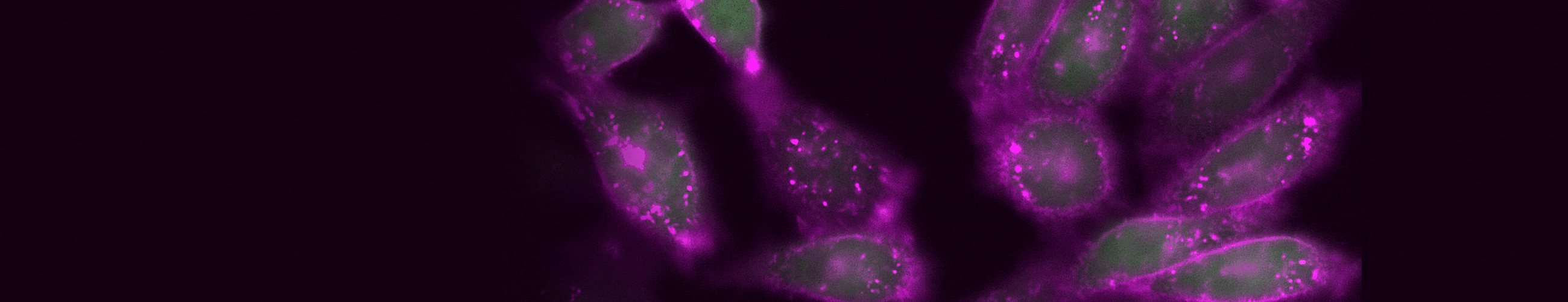
図3. TIGIT内部移行のタイムラプスイメージング。検出に使用した抗体:CoraLite® Plus 647標識抗TIGIT VHH抗体(カタログ番号:CL647-tgt、マゼンタ)
加えて、細胞膜貫通タンパク質に限らず、核、細胞質、オルガネラ膜等に局在する細胞内タンパク質についても、その細胞内局在を把握しておくことは重要です。使用する抗体のエピトープが細胞内コンパートメントの表面に露出しているかどうかを確認し、必要に応じて適切な固定・透過処理方法を検討する必要があります。これにより、抗体染色実験において、タンパク質の本来の局在を正確に反映させることが可能となります。これらの検討事項は、免疫蛍光染色や免疫組織化学等の顕微鏡観察実験において、結果の正確性を左右する重要な要素です。
6. プロセシングおよびシグナル伝達カスケード過程におけるタンパク質切断の検出
タンパク質の切断後フラグメントや切断部位を標的とする抗体は、アポトーシス研究におけるカスパーゼによって切断される基質タンパク質等、プロセシングの追跡に利用できます。例えば、PARP1はDNA損傷の修復に働くタンパク質である一方、カスパーゼの基質でもあり、カスパーゼによるPARP1の断片化はアポトーシス過程で生じる重要なマーカーの1つとして知られています。カスパーゼ等の各種プロテアーゼによるタンパク質の切断は、ホルモン前駆体、血液凝固カスケード、免疫系の補体活性化、Notch受容体シグナル伝達、ウイルスの侵入やウイルス病原性等、多くの生体機能における基本的な制御機構の1つです。
プロテインテックの関連製品:カスパーゼ抗体

図4. Staurosporine処理したJurkat細胞ライセートをSDS-PAGE後、Cleaved Caspase 3抗体(カタログ番号:25128-1-AP、希釈倍率1:1000)を使用して、室温で1.5時間インキュベーションしたウェスタンブロット。
7. タンパク質分解産物の同定
プロテアーゼによる切断と同様に、何らかの要因で生じるタンパク質分解産物は、解釈を混乱させたり、予期せぬ結果を招くことがあります。例えば、アクチンは多種多様なプロテアーゼやアポトーシスのような生体イベントによって分解されます。最もよく知られるアクチンタンパク質であるβアクチン(全長約42 kDa)の場合、しばしば35~38 kDa、~30 kDa、15 kDaの種々のフラグメントが検出されます。その中でも最も多く発生する35~38 kDaのフラグメントはアクチンのVal43残基とMet44残基間の結合が酵素的に切断されることで生じることが報告されています(PMID:9173887)。
使用する抗体が全長アクチンあるいは断片化アクチンのどちらを検出するのか把握することで、ウェスタンブロット等の実験結果を適切に解釈できるようになります。プロテインテックのBeta Actinモノクローナル抗体(カタログ番号:60008-1-Ig)は分解フラグメントを認識しますが、別のBeta Actinモノクローナル抗体(カタログ番号:66009-1-Ig)はN末端側の43アミノ酸残基を含む部位を認識して結合するため、一貫して全長タンパク質を検出します。エピトープ結合領域の情報を参考にして抗体を選択すると、タンパク質の適切な領域をターゲットにした実験が可能になり、高精度で信頼性の高い結果が得られます。

図5. Beta Actin抗体(カタログ番号:60008-1-Ig、希釈倍率1:5000)を使用した、複数の細胞株および組織ライセートのウェスタンブロット。生物種によっては42 kDa(全長Beta Actin)以外の分子量位置にバンドが検出されます。
8. 医薬品開発における創薬ターゲット
抗体を利用した創薬研究を行なうにあたり、エピトープの位置は受容体とリガンドの相互作用部位を阻害したり、シグナル伝達経路の活性化または抑制の制御機構に影響を及ぼします。例えば、抗体によるブロッキング処理や中和作用は、このような事例に該当します。生体内で生じる例としては、中和抗体はウイルスが宿主細胞に侵入する前に、ウイルスタンパク質の特定のエピトープをターゲットとし、感染の成立を防ぐ機構が挙げられます。効果的な医薬品や治療法を開発するには、こうしたエピトープの特定が不可欠です。
プロテインテックの関連製品:中和抗体

図6. 青:組換えヒトIL-6であるHumanKine® IL-6(カタログ番号:HZ-1019)は、添加濃度依存的にハイブリドーマ(クローン番号:3G12B10、GST Tagモノクローナル抗体産生クローン)の増殖を刺激します。赤:HumanKine® IL-6(カタログ番号:HZ-1019、1 ng/mL)の活性は中和抗体NeutraKine® IL-6モノクローナル抗体(カタログ番号:69001-1-Ig)の段階的添加によって中和されます(ND50=10~30 ng/mL)。
抗体結合部位を同定するエピトープマッピングは、がんの治療や自己免疫疾患のような治療に適用する抗体医薬品の開発で特に重要です。ターゲットタンパク質上のどの領域に抗体が結合するのか理解することは、治療効果に大きく影響を与える可能性があります。
がん領域では、がん細胞の細胞表面に存在する抗原を標的化するモノクローナル抗体が利用されています。エピトープへの理解が深まることで、がん細胞の増殖・生存に必須な領域に結合する抗体の開発が進み、より効果的でオフターゲット効果を抑えたより安全な医薬品の開発につながる可能性があります。
9. 抗体ペアの選択・構築
抗体のエピトープがあらかじめ判明していることは、サンドイッチELISA等の「抗体ペア」を利用する免疫アッセイ系の開発・構築に大きな利点となります。抗体ペアは「キャプチャー抗体(捕捉抗体)」と「検出抗体」の組み合わせからなります。同一タンパク質上の重複しない異なるエピトープを認識する抗体を選択することにより、アッセイの感度と特異性が大幅に向上します。サンドイッチELISA法は、Luminex®(Thermo Fisher Scientific)、Cisbio、Meso Scale Diagnostics、AlphaLISA®アッセイ、蛍光共鳴エネルギー移動(FRET:Fluorescence Resonance Energy Transfer)、近接ライゲーションアッセイ(PLA:Proximity Ligation Assay)等の様々なプラットフォームに利用されています。抗体ペアを用いたアッセイ開発では、基本的に様々な抗体を試験して最適な抗体ペアを選定するほか、「エピトープビニング(Epitope binning)」のようなモノクローナル抗体同士が同じエピトープ領域を共有しているかどうかを検討するためのアッセイ手法も活用されます。したがって、抗体のエピトープ部位に関する情報は、マルチプレックスアッセイの設計において極めて有用です。
プロテインテックの関連製品:マッチドペア抗体
まとめ
抗体のエピトープは、多様なアプリケーションに使用される抗体の機能性・特性を決定づける重要な要素です。特異性の担保や交差反応の低減、実験計画の最適化、治療効果の向上にいたるまで、エピトープマッピングと同定されたエピトープ情報は抗体試薬や免疫アッセイ系の信頼性・精度・実効性を向上させるための極めて重要なプロセスです。正確なエピトープ情報を把握することは、研究、診断、創薬のいずれにおいても高い精度と再現性のある結果を導く鍵となります。そのため、エピトープマッピングは単なる抗体特性評価法の1つとしてではなく、将来的には特定の抗体実験やアプリケーションで最適な抗体クローンや抗体試薬を選択するための必須の確認事項になる可能性があります。


