細胞骨格の高度な適応性/特徴
細胞骨格(cytoskeleton)は、細胞の細胞質に存在する極めて重要な構造体です。本稿では、細胞骨格の適応性が様々な細胞機能に不可欠であることや、細胞骨格を研究するための手法について解説します。
Katarzyna Szymanska-De Wijs著(ハノーファー医科大学博士課程在籍)
極めて適応性の高い細胞骨格
「細胞骨格(cytoskeleton)」という用語を耳にすると、細胞に形状を与え、細胞を支持する硬い「骨」状の構造体という印象を持つかもしれません。この想像は正しい側面もありますが同時に誤解も含まれます。細胞骨格は、確かに真核細胞における空間的組織化(spatial organization)をもたらす一方、細胞活動や外的要因に応答して絶えず変化を繰り返しています。細胞骨格は常に会合(assemble)と脱会合(disassemble)を繰り返すことから、細胞の中で最も変化に富み、最も動的な構造体の1つです。細胞骨格の基礎的な構成要素には、細胞骨格分子(細胞骨格タンパク質)である「アクチン(Actin)」と「チューブリン(Tubulin)」があります。単量体のアクチン(アクチンモノマー、球状アクチン、G-アクチン)は、重合して直鎖型または分岐型のアクチンフィラメント(線維状アクチン、F-アクチン)を形成します。アクチン構造は、細胞内の信号や外部からの危険信号に即座に応答して変化し、例えばフォルミンタンパク質等の重合促進因子、コフィリンタンパク質等の脱重合因子、αアクチニン等の架橋因子といった、異なるクラスのタンパク質によって高度に制御されています[1]。チューブリンは、重合して細胞内の物質輸送を担う微小管(microtubules)を形成します。また細胞骨格ネットワークの第3の構成要素として、ビメンチン(vimentin)等の「中間径フィラメント(Intermediate filaments)」があります。
細胞周期における細胞骨格の再編成
常に動的な状態にある細胞骨格の関与によって、様々な細胞活動が可能になります。その1つが細胞周期です。細胞が有糸分裂する際、微小管は再編成されて紡錘体を形成します。紡錘体は、有糸分裂における重要な構造体です。はじめに複製された染色体に付着し、続けて染色体を2つの娘細胞に分配します[2]。実は有糸分裂が実際に起こるより前から、分裂の準備段階にある細胞は大きく形状を変化させています。細胞膜内側の層状構造(細胞皮質)を構成する皮質アクチンのネットワークは、Rho-GTPase(Rhoファミリー低分子量Gタンパク質)のメンバーであるRhoAタンパク質の活性上昇によって徐々に厚みを失います。RhoAタンパク質は、細胞骨格の主要な制御因子であると考えられています。細胞皮質が薄くなることによって、細胞はより丸みを帯びた形状へ変化します。この現象は、紡錘体が機能を発揮するうえで非常に重要なプロセスです[3](図1)。
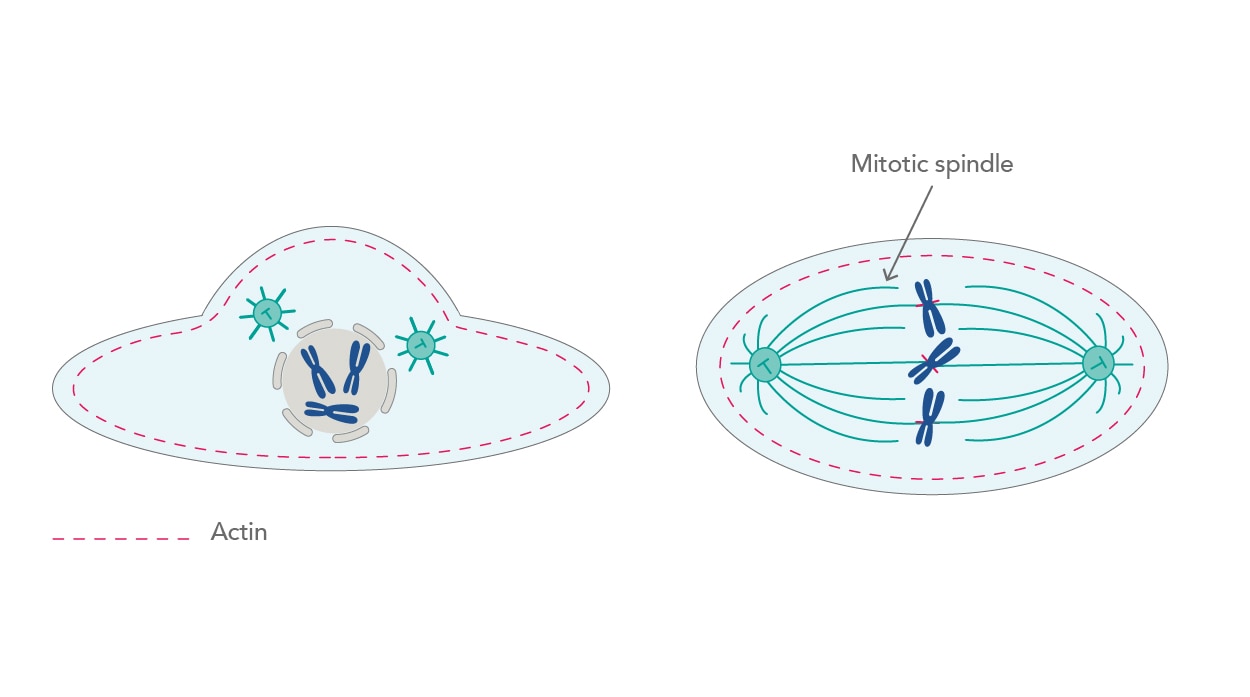 |
| 図1. アクチンネットワークの厚みが失われると、細胞は球形の形状となり有糸分裂が促進されます。 |
アクチンがもたらす運動性(motility/cell motility)は、細胞骨格が重要な役割を果たす細胞活動の1つです。例えば、白血球が異物を監視する際に細胞骨格が必要不可欠となります。常に重合と脱重合を繰り返す細胞骨格のリモデリングは、細胞の移動や形状変化を駆動する力を生み出します。定常的に形成されているフィラメントの分岐ネットワークは、細胞膜表面の受容体で検知される走化性分子に応答し、遊走する細胞の前端で細胞膜突起(membrane protrusions/cell protrusions)を形成して移動を促進します。細胞は前方表面に接着斑(focal adhesions)を付着させ、後端の接着斑が脱離して、一連の重合と脱重合により発生した力を使用して前進します(図2)[4、5]。
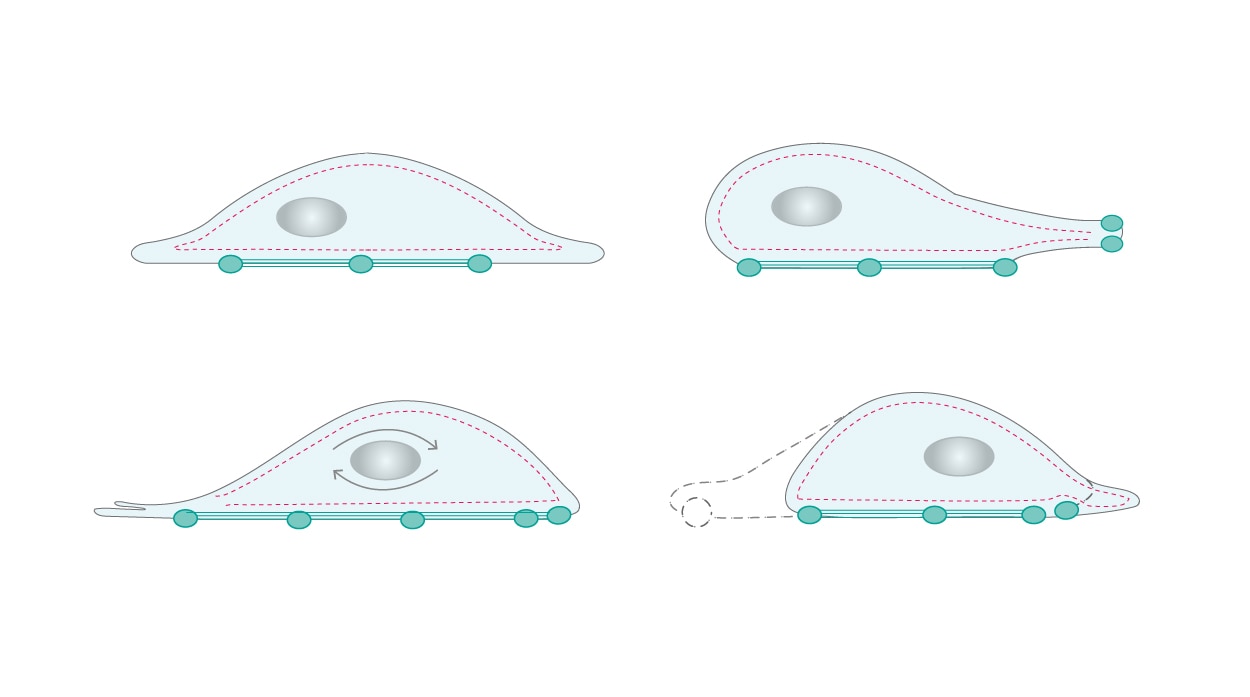 |
| 図2. 細胞の運動性には、細胞骨格ネットワークの継続的な重合/脱重合が必要となります。 |
細胞骨格ネットワークのもう1つの重要な用途は、細胞内物質の輸送です。ミオシンやキネシン等のモータータンパク質は、小胞やタンパク質をフィラメントや微小管に沿って目的地まで運搬します。この輸送プロセスは、病原体の細胞内への侵入時に悪用される場合や、感染によって妨害される場合があります。
細胞が「乗っ取り被害」に遭う時—感染細胞の細胞骨格に起きる事態とは?
偏性細胞内寄生性の病原体(Obligate intracellular pathogens)は、多くのステージと段階を経て感染を完遂させます。簡潔に言えば、病原体は細胞内へ侵入し、自身を複製し、隣接する細胞へ伝播します。病原体の感染過程において、病原体は宿主細胞へ侵入すると同時に、細胞骨格との最初の相互作用を生じさせます。例えば、細菌は哺乳類細胞に侵入するために「ジッパー機構(zipper)」、「トリガー機構(trigger)」、「貪食作用(phagocytosis)」の3種類の異なるアプローチを発達させてきました。すべてのアプローチは、キナーゼのシグナル伝達カスケード、アクチンフィラメントによる波打ち(ruffling)、付着部位での病原体の内部移行によって実行されます[6](図3)。
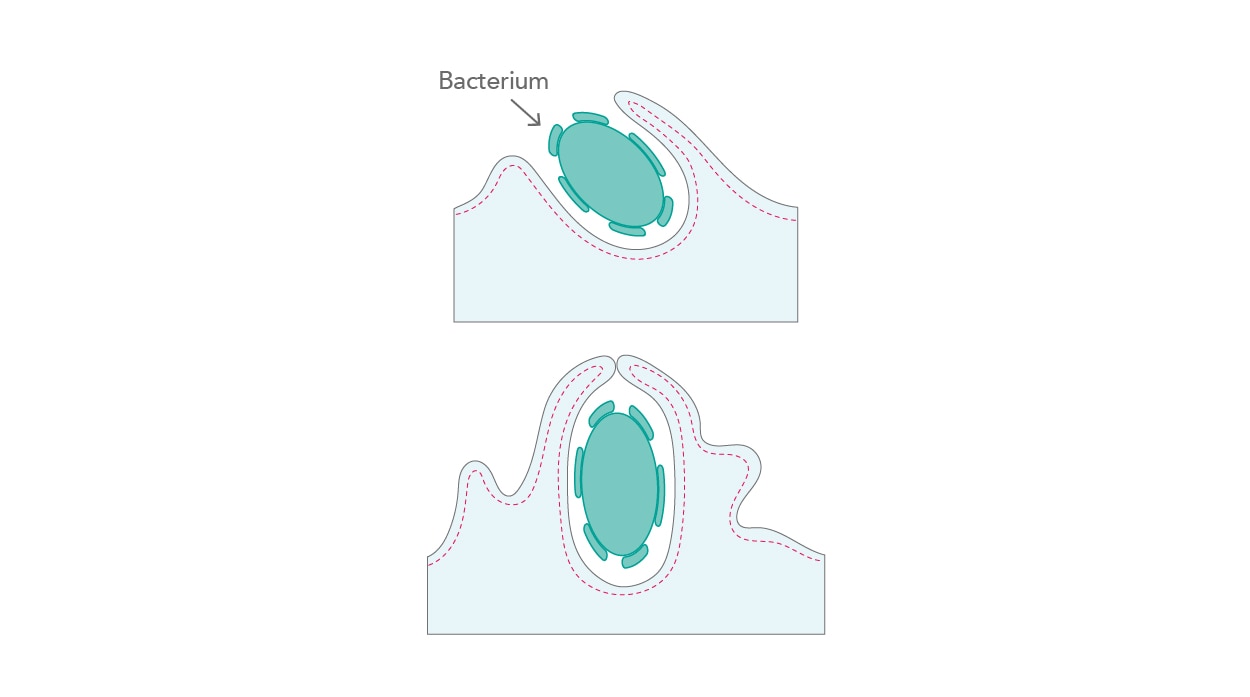 |
| 図3. アクチンフィラメントの波打ち(ruffling)と病原体の取り込み。 |
ウイルス類が宿主細胞へ侵入する経路には、大きく分けて「エンドサイトーシス経路」と「非エンドサイトーシス経路」の2種類の経路があります。エンドサイトーシス経路では病原体が細胞内へ容易に取り込まれます。非エンドサイトーシス経路では、病原体は細胞膜との融合や直接的な接触による侵入を介して取り込まれます(図4)。ウイルスによる膜のリアレンジメント(rearrangement)は非常に短い時間で生じます。インフルエンザウイルス粒子は、細胞内へ数秒以内に侵入し、AAV-2(アデノ随伴ウイルス)粒子にいたっては更に迅速に侵入します[7]。
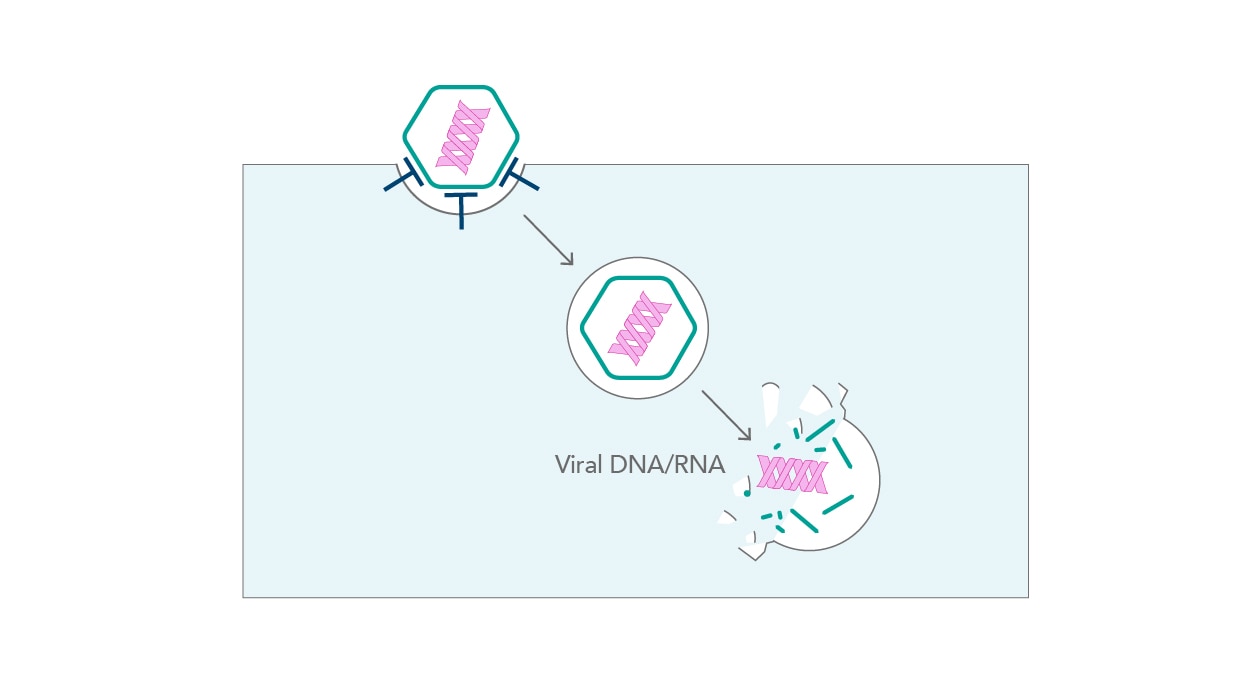 |
| 図4. ウイルスの侵入 |
病原体が細胞内へ取込まれると、免疫応答の回避と感染促進を目的として、病原体による新たな細胞骨格の操作機構が生じます。例えば、「アクチンの尻尾(actin tail、アクチンテール)」を構築し、自身の運動性を高める細菌もいれば(例:Rickettsia)、アクチンで封入体を形成して自身を隔離する細菌もいます(例:Chlamydia)[6]。ウイルスでは、モータータンパク質をハイジャックすることで、細胞内の移動に細胞骨格ネットワークを利用する場合や(例:HSV-1)[8]、ウイルスビリオン尾部にアクチンの重合化を惹起して、ウイルス自身の拡散促進に利用する場合があります(例:Vaccinia virus)[9、10]。また、風疹ウイルス(Rubella virus)のようにアクチンストレスファイバーの構造を完全に崩壊させることで感染を促進するウイルスもいます[10]。近年の研究結果では、新型コロナウイルス感染症(COVID-19)の感染爆発の原因となったSARS-CoV-2も劇的な細胞骨格の改変をもたらすことが示されています[11]。皮質アクチンは細胞膜に蓄積してSARS-CoV-2の放出や拡散への役割が示唆された一方で、中間径フィラメントは再構築されてウイルス複製オルガネラ(viral replication organelles、RO)の形成をサポートしている可能性が示唆されました。
増殖した病原体が細胞の外に出る際、病原体はアクチンリモデリングを強制して押し出され、最終的に細胞外に出芽します。また、ウイルスは「Intercellular extension(細胞間感染、移行、伝播)」を介して感染を拡大させる場合があります(図5)。Intercellular extensionでは、ウイルス粒子等を細胞外マトリックスへ放出する過程を経ることなく、感染していない細胞に接触して、ビリオン粒子、部分的に組み立てられた粒子、ヌクレオカプシド等を拡散するために、感染細胞がアクチンによる構造物を形成します[12]。
 |
| 図5. 「Intercellular extension」により感染効率が増し感染速度が加速します。 |
細胞骨格再編成の研究に用いられる抗体
蛍光イメージング法は、細胞骨格に関する知見と理解を深めるために必須の技術です。現在の科学技術を用いれば、細胞骨格タンパク質の一過性の発現パターンや特別な発現パターンを検出することが可能です。こうした技術領域には、異なる原理によるイメージング手法(例:共焦点顕微鏡)だけではなく、多様なサンプル調製の手法が存在します。抗体は、目的のタンパク質を染色するために最も一般的に用いられるツールです。抗体による免疫蛍光染色には2通りの手法があります。1つは蛍光色素が直接標識された一次抗体を用いる「直接免疫蛍光染色法」であり、もう1つは二次抗体を使用する必要のある「間接免疫蛍光染色法」です。以下の表には、細胞骨格研究によく使用される一次抗体をまとめました。その他の細胞骨格に関連する抗体についてはプロテインテックの注目製品「特集:細胞骨格マーカー」をご覧ください。
表1. 細胞骨格研究によく使用される一次抗体
プロテインテックは、CoraLite®(コーラライト)蛍光色素を標識した一次抗体を提供しています。蛍光色素が直接標識された抗体は、免疫蛍光染色ワークフローの短縮からバックグラウンドシグナルの抑制に至るまで、優れた利点を提供します。CoraLite®蛍光色素を標識した製品の利点に関する情報はプロテインテックのブログ「IF(免疫蛍光染色)においてCoraLite®で直接染色する利点」をご覧ください。プロテインテックのウェブサイトでは、CoraLite®標識細胞骨格マーカーを数多く紹介しています。
|
CoraLite® Plus 488-conjugated Beta Actin Monoclonal antibody |
|
|
CoraLite® Plus 488-conjugated TUBB3-specific Monoclonal antibody |
CoraLite® Plus 488-conjugated Beta Tubulin Monoclonal antibody |
表2. 細胞骨格用CoraLite®標識抗体の一例
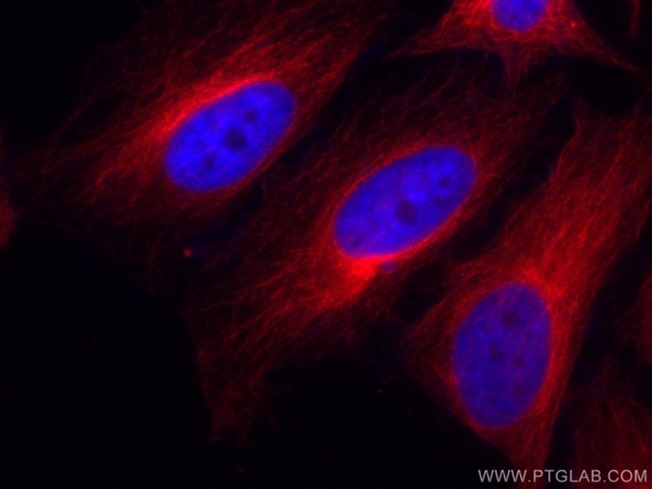 |
| 図6. HeLa細胞のAlpha-tubulinの免疫蛍光染色像。HeLa細胞を4% PFAで固定 CoraLite®標識Alpha Tubulin抗体(カタログ番号:CL594-66031、希釈倍率1:100)を使用した。 |
また、プロテインテックは細胞骨格研究を推進するリコンビナント(組換え)モノクローナル抗体も提供しています。リコンビナント抗体は、既知のDNA配列と高収率な細胞発現系を用いて遺伝子組換え技術により作製された抗体です。プロテインテックのリコンビナント抗体は、ロット間一貫性、高い再現性、優れた特異性等に関して、従来のハイブリドーマ技術を用いて作製された抗体と同等以上の利点を示します。プロテインテックは、smooth muscle actin specific recombinant抗体(カタログ番号:80008-1-RR)等の細胞骨格研究に関連する各種製品を提供しています。リコンビナント抗体の詳細についてはプロテインテックの組換え抗体(リコンビナント抗体)をご覧ください。
ファロイジン(Phalloidin)は、抗体とは別にアクチンフィラメントを染色するために用いられる有用なツールです。キノコ類であるタマゴテングタケ(Amanita phalloides)が産生する毒素であるファロイジンは、F-アクチンと特異的に結合して、脱重合を阻害します。蛍光色素を標識したファロイジンによる染色は、抗体による染色と比較して蛍光密度が高くコントラストの高い画像を撮影できます。プロテインテックは2種類の蛍光色素を標識したファロイジン、CoraLite® Plus 488-Phalloidin(緑色)およびCoraLite®594-Phalloidin(赤色)を提供しています。
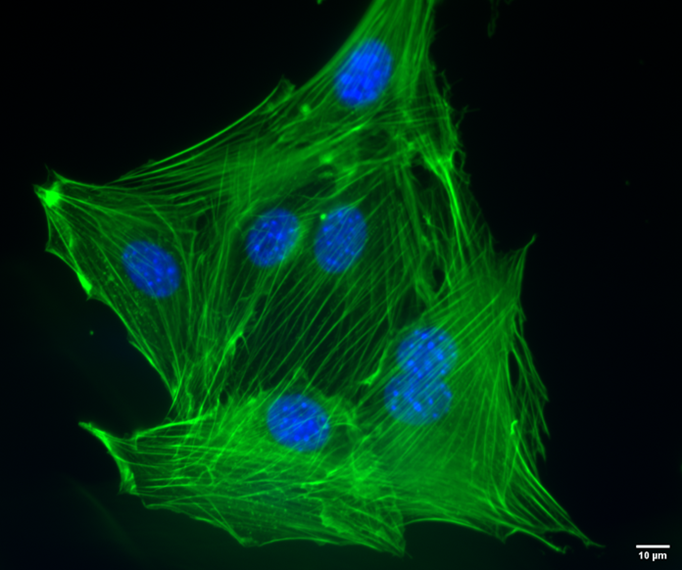 |
| 図7. CoraLite® 488標識ファロイジン(カタログ番号:PF00001、希釈倍率1:50)を使用したNIH3T3細胞(マウス線維芽細胞株)の蛍光染色像。核:Hoechst 33342で染色。スケールバー:10 μm。撮影:Katarzyna Szymanska-De Wijs(ハノーファー医科大学)。 |
参考文献
- D A Fletcher, R D Mullins. Cell mechanics and the cytoskeleton. Nature. 2010 Jan 28;463(7280):485-92.
- Y Nakaseko, M Yanagida. Cell biology. Cytoskeleton in the cell cycle. Nature. 2001 Jul 19;412(6844):291-2.
- F Rizzelli, et al. The crosstalk between microtubules, actin and membranes shapes cell division. Open Biol. 2020 Mar;10(3):190314.
- https://home.uni-leipzig.de/pwm/web/?section=introduction&page=motility
- M Mastrogiovanni, et al. Coordinating Cytoskeleton and Molecular Traffic in T Cell Migration, Activation, and Effector Functions. Front Cell Dev Biol. 2020 Oct 21:8:591348.
- P M Colonne, C G Winchell, D E Voth. Hijacking Host Cell Highways: Manipulation of the Host Actin Cytoskeleton by Obligate Intracellular Bacterial Pathogens. Front Cell Infect Microbiol. 2016 Sep 22:6:107.
- D S Dimitrov. Virus entry: molecular mechanisms and biomedical applications. Nat Rev Microbiol. 2004 Feb;2(2):109-22.
- K Radtke, et al. Viral interactions with the cytoskeleton: a hitchhiker's guide to the cell. Cell Microbiol. 2006 Mar;8(3):387-400.
- S Cudmore, et al. Actin-based motility of vaccinia virus. Nature. 1995 Dec 7;378(6557):636-8.
- S Cudmore, et al. Viral manipulations of the actin cytoskeleton. Trends Microbiol. 1997 Apr;5(4):142-8.
- M Cortese, Y Schwab, R Bartenschlager, et al. Integrative Imaging Reveals SARS-CoV-2-Induced Reshaping of Subcellular Morphologies. Cell Host Microbe. 2020 Dec 9;28(6):853-866.e5.
- N Cifuentes-Muñoz, et al. Direct cell-to-cell transmission of respiratory viruses: The fast lanes.PLoS Pathog. 2018 Jun 28;14(6):e1007015.
*本ブログのイラストはFrederik de Wijs氏が作成しました。


