ヒントとコツ | 免疫組織化学のためのマウスオンマウス
マウス組織にマウス由来抗体を使用するIHC実験は、オフターゲット染色の可能性が生じるため、困難な実験となる場合があります。そうした問題を軽減し、信頼性のある結果を得るためのマウスオンマウス染色の実施方法を学びます。
マウスモデルは、基礎生理学の解明から創薬の促進に至るまで、ライフサイエンス研究において幅広く使用されています。免疫組織化学(IHC:Immunohistochemistry)は、マウス組織でよく使用される手法であり、組織中の特定のタンパク質の関与や、実験条件に対してどのような反応を示すかを可視化します。この手法の欠点の1つは、多くの抗体(特にモノクローナル抗体)がマウスで産生されることです。これにより、マウス組織で「抗マウス」二次抗体を使用すると、組織内在性マウスIgGやFc受容体に結合する可能性があり、高いバックグラウンドや非特異的染色の原因となります。そのため、多くの研究者は当然のことながら、マウス組織へのマウス由来一次抗体の使用に慎重であり、概してそのような実験を回避する傾向にあります。しかしこの記事で取り上げる染色のヒントがあれば、マウスオンマウス(MOM)実験を必ずしも避ける必要はなく、使用したいと考えている抗体をマウス組織でも引き続き使用できます。
Tip 1:実際に試して確認する―コントロール実験―
どのような場合にMOM染色が高いバックグラウンドや非特異的シグナルを生じさせるかの予測は困難です。そのため、この段階での最善策は、適切なコントロールを設定して実際のバックグラウンド染色の程度を明らかにし、実験結果の信頼性を評価することです。まずは計画通りにIHCを実施してみましょう。その際に可能であれば、一次抗体を使用しないで二次抗体のみを使用するコントロール実験と、一次抗体の代わりにアイソタイプコントロール抗体*を使用するコントロール実験も設定してください。こうしたコントロール実験を実施すると、観察されたシグナルは二次抗体がオフターゲットに結合することで生じたシグナルではなく、一次抗体と二次抗体の特異的結合に由来するシグナルであることを確認することができます。コントロール実験でバックグラウンドが確認されない場合は、実験結果に問題はありません。後で問題が発生した場合に備えて、すべての実験でこれらのコントロールを含めて実施してください。また、プロテインテックでは抗体交換/補填保証対応を実施しております。そのためプロテインテックのマウスモノクローナル抗体を安心してお試しいただけます。もし、マウス組織で高いバックグラウンドが確認され、ご満足いただけない場合は交換を含めた保証を利用可能です。
*アイソタイプコントロール抗体を使用する場合は、一次抗体と同じサブクラス抗体(マウスには4つのIgGサブクラスがあります)を同じ濃度で使用してください。一次抗体と同一メーカーの製品の使用を推奨します。
プロテインテックの関連製品:アイソタイプコントロール抗体
Tip 2:内在性マウスIgGのブロッキング
多くの場合、内在性IgGは組織内の残留血液が原因となり存在しています。したがって、MOM染色で高いバックグラウンドが認められた場合、第一の対処法として4%パラホルムアルデヒドによるマウスの潅流や摘出組織の浸漬固定の前に、氷冷したPBSでマウスを灌流することが挙げられます。
プロテインテック製品をご利用いただいたお客様より、リン酸化タンパク質をターゲットとするモノクローナル抗体を使用したIHC染色において、極めて高いバックグラウンド染色が認められ、一次抗体を使用せず二次抗体のみを添加したネガティブコントロール実験でもバックグラウンド染色が生じるというご相談が寄せられました。プロテインテックは組織サンプル中の内在性IgGの存在がバックグラウンド染色の原因であると推測し、PBSによる動物サンプルの灌流の実施を提案しました。灌流実施後、バックグラウンド染色は著しく低減し、予測した通りの明瞭な抗体染色パターンを観察できました。
灌流が不可能な実験の場合、または、灌流を実施しても高いバックグラウンドが見られる場合、次の対処法として、内在性マウスIgGのブロッキングをお試しください。一次抗体や二次抗体で染色する前に、推奨濃度0.1 mg/mlのF(ab)フラグメント抗マウスIgG抗体とインキュベーションします。これは、二次抗体宿主由来の血清(例:ヤギ正常血清)や0.5% Triton-X含有BSA等とインキュベーションする通常のブロッキング操作の後に実施されます。この追加のブロッキング操作を実施してから、通常通り抗体染色を実施してください。
補足:FFPE(ホルマリン固定パラフィン包埋)試料のFc受容体は、通常はIHCプロトコールの固定、脱水、パラフィン除去の各操作で非活性化されるため問題になりません。ただし、Fc受容体が高いバックグラウンドの原因である可能性が考えられる場合は、この記事のTip 2〜4を実施してこの現象を防止・回避してください。
Tip3:直接標識抗体を使用する
MOM染色の問題の大部分は二次抗体に起因し、直接蛍光標識された一次抗体を採用して二次抗体を使用しないことで、こうした問題を排除することが可能となります。
プロテインテックは、汎用性の高いFlexAble(フレクサブル)抗体標識キットを販売しています。FlexAble抗体標識キットを使用すれば、二次抗体のオフターゲットへの結合を懸念することなく、お手持ちの任意のマウス抗体に蛍光色素を直接標識してマウス組織を染色することができます。さらに、このキットを使用すれば、同種の免疫動物由来の一次抗体によるマルチプレックス(多重)染色も容易に実施することが可能になります。プロテインテックは6種類の異なる蛍光色素を標識可能なキットを提供しています。最小スケールで、1回の標識反応につき0.5 μgの一次抗体をわずか10分程度で標識できます。
さらに、様々な抗体メーカーが検出酵素や蛍光色素を直接標識した一次抗体を製造しています。酵素標識一次抗体や蛍光色素標識一次抗体の使用には、IHCプロトコールの簡略化、バックグラウンドの低減、解像度の向上、MOMにおける二次抗体の問題の排除等の複数の利点が存在します。プロテインテックは、多くの汎用的なマウスモノクローナル抗体にCoraLite®(コーラライト)/CoraLite® Plus(コーラライトプラス)蛍光色素を直接標識し、IHCや免疫蛍光染色で多岐に及ぶ検証を実施した蛍光標識済み一次抗体製品を提供しています。免疫蛍光染色では、主にCoralite®488 /Coralite® Plus 488、 Coralite®594/Coralite® Plus 594 、Coralite®647/Coralite® Plus 647等の複数の色素を用いて多重染色を実施可能です(図1参照)。
プロテインテックの関連製品:CoraLite®(コーラライト)蛍光標識抗体

図1. 精巣タンパク質BOULE(a、b、c)、DAZL(d、e、f)、TNP1(g、h、i)に対してCoraLite®直接標識抗体を一次抗体として実施した免疫染色の結果。CoraLite®488(a、d、g)、CoraLite®594(b、e)、CoraLite®555(h)、CoraLite®647(c、f、i)を使用。本実験はマウスの精巣組織で実施されました。
Tip 4:抗体複合体を形成させる
Tip2やTip3で挙げた対策の代わりに、一次抗体-二次抗体複合体を形成させてから組織とのインキュベーションを実施することでMOM染色の問題を改善することができます。この方法についてGoodpaster and Randolph-Habecker (2014)らが成功例を発表しています。論文ではマウス由来一次抗体とビオチン標識F(ab)フラグメント抗マウスIgG二次抗体を1:2の比率(一次抗体1 µgあたり二次抗体2 µg)で20分間インキュベーションして抗体複合体を形成させた後、遊離の二次抗体を阻害するために二次抗体1 μgに対してマウス正常血清10μlを混合してさらに10分間インキュベーションすることで調製されました。この処理を行った抗体複合体を組織スライドに添加・結合させ、続いてストレプトアビジン-HRPで検出します。この方法だと、組織に添加する前に二次抗体が一次抗体に結合し、一次抗体に結合しなかった二次抗体はマウス血清に結合するため、二次抗体がオフターゲットへ結合することはありません。二次抗体がオフターゲットに結合していないことは図2にわかりやすく示されています。ビオチンを使用しない検出方法やその他の方法の詳細については論文Goodpaster & Randolph-Habecker (2014)をご覧ください。
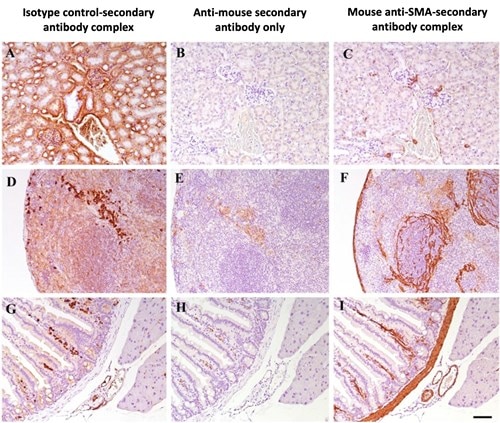
図2. 腎臓(A、B、C)、脾臓(D、E、F)、腸(G、H、I)組織。抗マウス二次抗体のみで染色した場合(A、D、G)は、生物学的シグナルと誤認される可能性のある多くの非特異的染色が観察されます。一次抗体をアイソタイプコントロール抗体に置き換え、あらかじめF(ab)フラグメント抗マウスIgG二次抗体と複合体を形成させた場合においてはシグナルが認められず(B、E、H)、抗SMAマウス抗体とF(ab)フラグメント抗マウスIgG二次抗体を使用した複合体では特異的な染色が認められます(C、F、I)。SMA=平滑筋アクチン(smooth muscle actin)。図はGoodpaster & Randolph-Habecker (2014)から引用しました。
最後に
IHC実験は、順調に実験が進んでいる時であっても注意が必要な場合があり、マウスオンマウス染色は特に困難な実験です。高価な市販のキットを使用せずにこうした問題を軽減して論文化に値する結果を出す方法が多数あることを、ここまでご紹介しました。良い実験結果が得られることをお祈りします!
Rebecca Northeast著(プロテインテック プロダクトマネージャー)