アルツハイマー病の神経病態に類似したCOVID-19の神経病態—Long COVIDにおけるリアノジン受容体の役割
Leah Sittenfeld著(ニューヨーク医科大学、M.D. Candidate)
COVID-19のパンデミックから3年が経過し、願わくばパンデミック終息へ向かう現在、SARS-CoV-2感染者の神経症状や後遺症に関する報告が相次いでいます。COVID-19の神経症状は、嗅覚障害・味覚障害等の軽度な症状1から、より重篤な脳卒中発症リスクの増加2や「Long COVID」と定義される長期的な認知機能障害(代表例:ブレインフォグ)まで多岐にわたります。COVID-19感染後の神経症状には、神経組織へのウイルスの直接感染、低酸素性虚血の間接的な影響による脳障害、全身性炎症反応症候群を引き起こす免疫系の異常な活性化2等の様々な機構が存在すると考えられます。興味深いことに、SARS-CoV-2のウイルスRNAは感染患者の脳組織の約50%だけに検出され3、このことから、脳細胞の直接的なウイルス感染はCOVID-19感染後の神経症状発症の主要な機構ではない可能性が示唆されています。
リアノジン受容体(RyR)が認知機能障害と関連する背景
2021年から2022年にかけて、本ブログの著者が所属する研究室では、COVID-19関連認知機能障害におけるリアノジン受容体(RyR:Ryanodine receptor)の役割を調査する小規模な試験を行い、アルツハイマー病(Alzheimer’s disease)に認められる病態と類似した生化学的パターンを明らかにしました。リアノジン受容体は、筋小胞体/小胞体に存在するホモ四量体の細胞内カルシウムイオン放出チャネルです。骨格筋、心筋、脳をはじめとする多くの生体組織において、細胞質内カルシウムイオン濃度を厳密に維持するために機能します。カルシウムイオンは、全身を通じて鍵となるシグナル伝達分子であり、心筋や骨格筋の筋収縮において極めて重要な役割を果たすと同時に、神経伝達やニューロンによる記憶形成においても重要な役割を果たします。したがって、カルシウムイオンの恒常性破綻は、病態形成において極めて重要な役割を果たします。リアノジン受容体の機能不全は、心不全4、筋ジストロフィー症5、アルツハイマー病6等の多くの疾患に関連することが示されています。リアノジン受容体のリン酸化修飾や酸化修飾等の翻訳後修飾によって、イオンチャネルの状態を安定化するサブユニットであるカルスタビン(Calstabin 2)が解離し、リアノジン受容体はカルシウムイオンが漏出しやすい表現型を示すようになり、細胞内の貯蔵カルシウムイオンが枯渇して細胞/組織の機能不全に至ります7。免疫調節性のサイトカインで、線維化や組織修復等の抗炎症性作用にも関与するTGF-βは、SMAD依存性経路を活性化し、活性酸素種(ROS)産生を促進します8。SMAD依存性経路を介したROSの増加により、リアノジン受容体は過剰に酸化されイオン漏出型受容体になります。この異常を呈したリアノジン受容体は、病態に寄与することが過去の研究において示されています9。
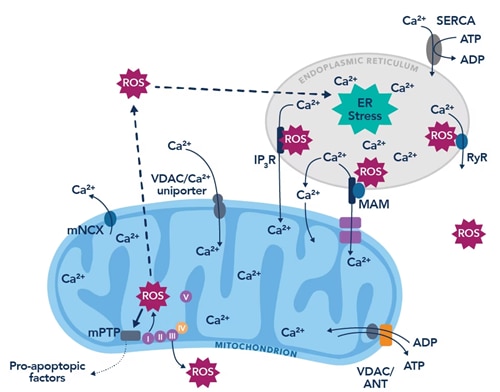
図1. 小胞体のカルシウムイオン漏出とROS産生の悪循環(Görlach et al., 201510に掲載された図を改変)
アルツハイマー病とCOVID-19に共通して観察される経路活性化
SARS-CoV-2はACE2受容体を感染宿主細胞への侵入に用い、宿主細胞の複製機構を利用して増殖し、新たな細胞に感染します。COVID-19感染者の場合、ACE2受容体のダウンレギュレーションとTGF-βのアップレギュレーションが同時に認められ、重症患者は血清TGF-βの濃度が高いことが示されています11, 12。さらに、ACE2受容体の発現低下は、アルツハイマー病の代表的な神経病態学的特徴である、過剰にリン酸化したタウタンパク質の存在やアミロイドβ(Aβ:Amyloid-beta)の増加と関連しています13。過剰にリン酸化したタウタンパク質は、特徴的な「粘着性」を示し、細胞内に神経原線維変化(NFT:Neurofibrillary tangle)タウ凝集体を形成して細胞機能を妨害し、最終的には神経細胞が死滅します。アミロイドβはニューロンの細胞間隙に蓄積しますが、その機構は完全には解明されていません。アミロイドβの蓄積は脳内の炎症経路を活性化することが示されており14、この場合も神経細胞死を誘発します。一連の研究で報告された、ACE2受容体の減少、TGF-βの産生増加とそれに伴うリアノジン受容体の酸化や、イオン漏出型リアノジン受容体の増加とアルツハイマー病との関連性を踏まえると、神経変性疾患の既往がないにもかかわらずCOVID-19で死亡した患者に認められた神経病態が、どのような生化学的経路によって生じているのか、さらに研究する必要性が示唆されました。
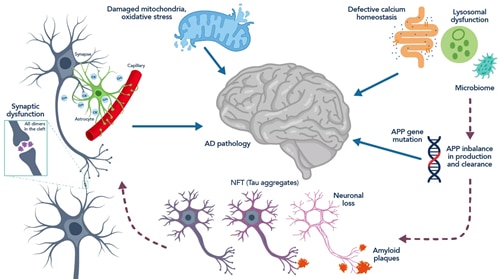
図2. アルツハイマー病に関連する神経病態と病態生理の模式図(Hany et al., 201619掲載の図を改変)
COVID-19の神経病態生理におけるリアノジン受容体の関与を示唆する生化学的所見
COVID-19により死亡した患者の大脳皮質と小脳から採取した試料を、免疫ブロットで解析したところ、対照群と比較して、リアノジン受容体2(RyR2)結合カルスタビンが減少し、リン酸化・酸化・ニトロシル化RyR2の増加が認められました。それに加え、リン酸化SMADが増加していることを根拠とする、ROS産生に寄与するSMAD経路の活性化の亢進が示されました。さらに、一連の試料の解析によって、大脳皮質と小脳の両者において過剰にリン酸化されたタウタンパク質が著しく増加していることが明らかになりました15。この特徴はアルツハイマー病に典型的な所見とは異なります。アルツハイマー病では主として大脳皮質に過剰にリン酸化されたタウタンパク質が認められます。コロンビア大学のAndrew R. Marks教授とARMGO Pharma, Inc.が開発したRycalの一種である新規低分子薬ARM210をex vivoで適用した試料では、リン酸化・酸化・ニトロシル化修飾されたチャネルへのカルスタビンの結合が回復しましたが、チャネル自体の修飾状態は変化しませんでした。ARM210は漏出型を示すチャネルの機能を回復させることが既に認められており16、COVID-19における認知機能障害の治療を目的とする候補薬となっています。
研究の今後について
本ブログの著者が所属する研究室とは異なるグループが実施した最新の研究でも、COVID-19感染者のうち、特に高齢者のアルツハイマー病発症率の上昇に関するエビデンスが確認されています17。他にも、インフラマソームを介した炎症反応が亢進することを示した報告も存在します18。このインフラマソームを介した炎症は、アルツハイマー病患者の脳内に認められるものと類似するNFT形成の一因となる、キナーゼとホスファターゼの均衡崩壊の原因になり得るとされています。所属研究室は、アルツハイマー病の病態に関連する、リアノジン受容体機能障害・酸化ストレス・タウタンパク質の過剰リン酸化経路の活性化が、互いに影響しながら悪循環を形成する具体的な経路を提唱する研究を発表しています。この神経損傷機構は、過去に実施したアルツハイマー病を対象とした研究結果6とも一致しており、多くのCOVID-19感染者が示す認知障害の根底にある病態について独自の見解を示すものです。このような発見を活かして、リアノジン受容体等が関与する経路に介入し、機能障害の改善や、COVID-19による神経変性の発症や進行を防止する治療の研究をさらに進めることができると考えられます。
リアノジン受容体抗体
|
RYR1ポリクローナル抗体
|
CoraLite® Plus 647 RYR2ポリクローナル抗体
|
|
RYR1抗体(カタログ番号:26968-1-AP)を使用したパラフィン包埋マウス脳組織の免疫組織化学染色。 |
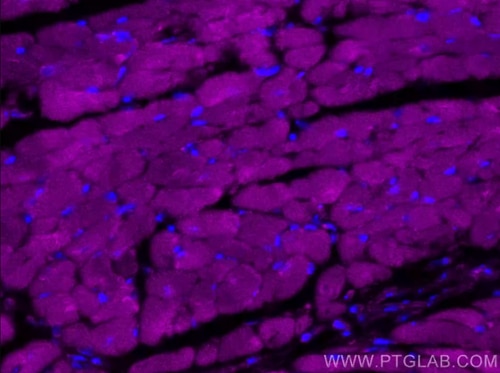
CoraLite® Plus 647 RYR2抗体(カタログ番号:CL647-27587)を使用した4% PFA固定マウス心臓組織の免疫蛍光染色。 |
参考文献
10. A Görlach, et al. Calcium and ROS: A mutual interplay. Redox Biol. 2015 Dec:6:260-271.