細胞の老化とマーカー
細胞はどのようにして「細胞停止」状態になるのでしょうか。細胞の老化とは何か、そして、細胞の老化と病気の関係について解説します。
細胞老化とは?
「老化」とは、単純に、加齢に伴う外延的プロセスとして定義されます。いかなる対象でも永久に続くものはなく、細胞の増殖能力についても同じことが言えます。ヘイフリック限界(Hayflick limit)では、in-vitroで増殖している細胞は約50~60回の細胞分裂後にいわゆる細胞老化の状態になると述べられています1 (PMID:13905658)。この細胞周期の恒久的な停止は、細胞を生存可能にした状態で増殖させず、その形質を変化させます。当初は、ディッシュ中で細胞を培養することによるアーチファクトと思われていましたが、加齢による老化現象やがん病変を観察した結果、同様の現象がin vivoでも認められました。そうした細胞は、不可逆的な非増殖性の老化状態に入っていることが明らかになり、組織や生物にとって何らかの意味があることが示唆されました。
老化は有益か有害か?
老化は細胞分裂を停止させますが、その目的については意見が分かれています。ある仮説では、細胞の老化は有益であることが示唆されており、腫瘍の増殖を抑制するための抗がんプロセスとして進化したのではないかと考えられています。別の仮説では、細胞の再生能力が失われると老化が進むため、細胞の老化は有害であるとされています2(PMID:24954210)。
何十年も経った今でも、どちらの仮説が有力な説かわかっていません。実際、研究が進むにつれ、老化は、その状況によりプラスの効果とマイナスの効果の両方を併せ持つのではないかと考えられるようになっています。生物が幼若なときには、細胞老化による抗腫瘍効果は有用であるものの、生物が老化するにつれて、この同じ過程が有害になります。細胞老化は通常、細胞増殖した後に生じるため、細胞の世代を超えて存続していきます。これは拮抗的多面発現(antagonistic pleiotropy)として知られています。
老化現象は全ての組織に認められており、多くの疾患で何らかの役割を果たすと考えられ、生物学の様々な分野にわたって研究する価値のある現象です。
老化現象は病気に関係しているのか?
がんの分野では、老化はがんからの保護的効果や原因となる効果を有する可能性があるため、興味深い対象です。がん遺伝子の発現は、老化の初期に認められる細胞周期の停止を誘導し、悪性組織の異常増殖を阻害します。しかし、長期的老化および細胞老化随伴分泌現象(SASP:senescent-associated secretory phenotype)因子の発現は、微小環境を変化させることが知られています7,8(PMID:20078217、27797960)。実際、MMP-3等のSASPの一部として発現しているいくつかの因子は、腫瘍転移を促進する可能性があります。癌の治療に対してより効果的に応用するためには、がんという現象に老化のもたらす有益な結果と有害な結果を、非常に基本的なレベルで区別する必要があります。
細胞老化は、正常な加齢で重要な役割を担いますが、神経変性疾患においても重要な役割を担う可能性が示唆されています9(PMID:30261683)。年齢は、アルツハイマー病(AD)、パーキンソン病、さらには多発性硬化症(MS)における再発寛解型から進行型への移行に関する重要なリスクファクターの1つです。加齢による老化細胞の蓄積は、これらの疾患の発症リスクの増加の一因となっている可能性があります。SASPでは、ADを呈する脳内でアップレギュレーションされる分子と一致する数多くの炎症促進性因子が放出されます。高齢者の脳の損傷修復能力の欠如、特にMSにおける再髄鞘化能力の欠如は、細胞増殖能の欠如と関連し、したがって老化とも関連しています。いくつかのタイプの脳細胞の老化マーカーが示されており、完全には解明されていないものの活発な研究分野になっています。
老化を確認するためには、どのようなマーカーを使用するのか?
研究者が老化を研究する際、老化状態の特定に使用できる単一のマーカーが存在しないという問題があります。老化細胞は代謝的な活動は行いますが細胞分裂せず、休止期の細胞とは異なるものの、両方とも有糸分裂後の細胞であるため、単に増殖しないということだけでは細胞老化状態にあると呼ぶには十分ではありません。ある特定の特性によりこうした細胞を識別することができますが、複数の特性を評価する必要があります。
- DNA損傷応答(DDR)マーカー
細胞性ストレスにより、2本鎖切断やDNA損傷が特にテロメアで生じ、これがDNA損傷応答(DDR)を引き起こします。これは、老化のマーカーとして使用することができるH2AX等のタンパク質の発現の変化をもたらします。DDRはDAPIによる斑点状染色で可視化することも可能で、老化関連ヘテロクロマチン構造(SAHF:senescence-associated heterochromatin foci)として知られています3(PMID:23140366)。
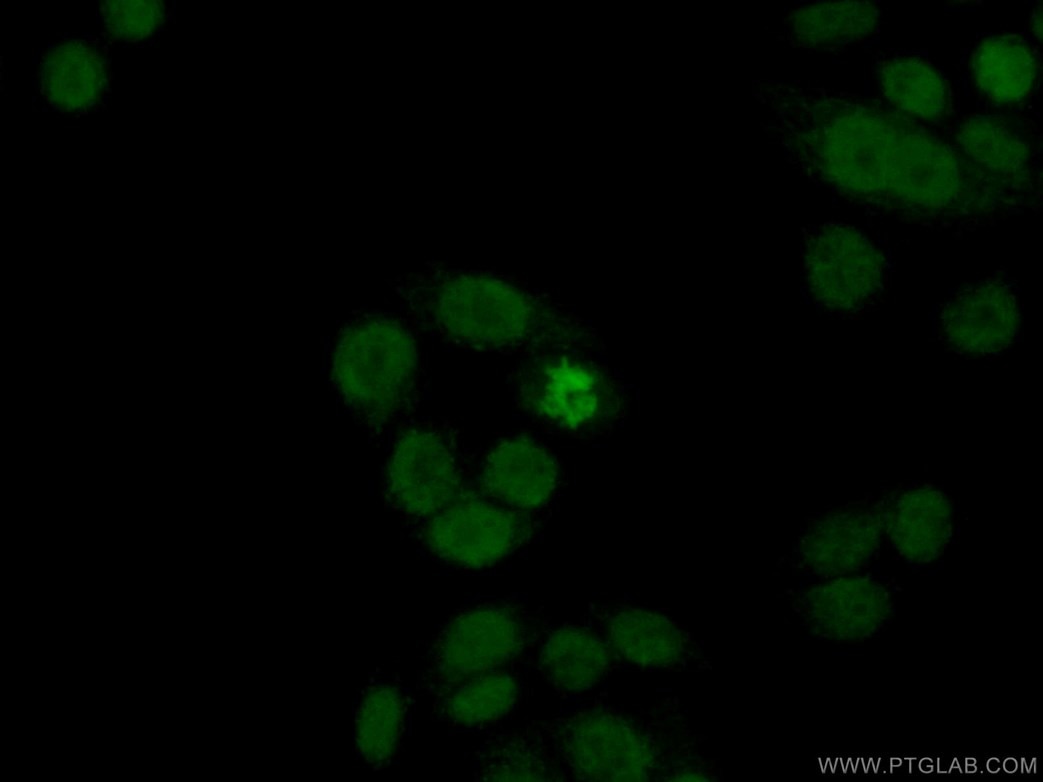
図1. 1:50に希釈したヒストンH2A.X抗体(カタログ番号:10856-1-AP)と、Alexa Fluor 488標識AffiniPureヤギ抗ウサギIgG(H+L)抗体を用いて、固定(4% PFA)したHeLa細胞の免疫蛍光染色の解析像。
- 腫瘍抑制因子と細胞周期調節因子の発現
p16ink4aによる染色は、最も定評のある老化マーカーの1つです。通常、この腫瘍抑制タンパク質は、G1期からS期へのチェックポイントで細胞周期を遅らせます。このチェックポイントで作用する他の細胞周期調節因子には、p21とp53があり、これらのタンパク質のいずれかの濃度が高い状態は細胞周期の停止をもたらし、また、老化現象の兆候を示している状態といえます。こうしたタンパク質がすべて高レベルで発現している場合、その細胞が老化型の細胞である可能性がより高くなります4(PMID:23416979)。
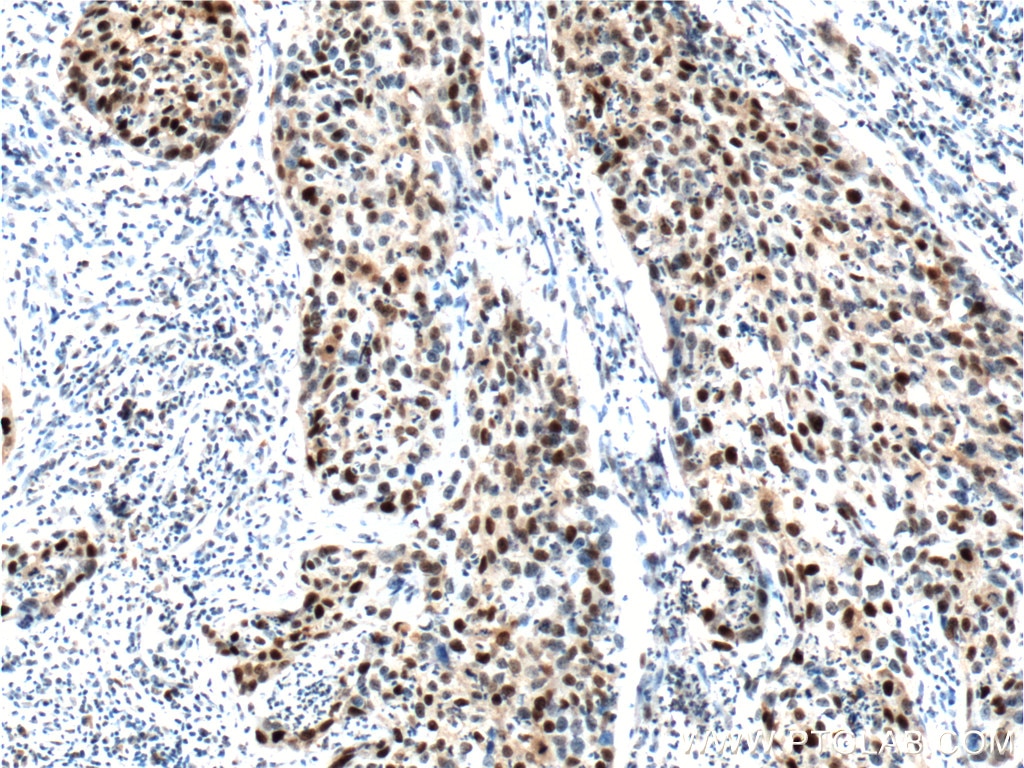
図2. 1:400で希釈したP21;CDKN1A抗体(カタログ番号:10355-1-AP)を用いたパラフィン包埋ヒト子宮頸がん組織スライドの免疫組織化学染色の解析像(40倍レンズを使用)。Tris-EDTA緩衝液(pH9)で熱処理し抗原賦活化した試料を使用。
- SA-β-gal染色
老化関連β-ガラクトシダーゼ(SA-β-gal)は、老化細胞に特異的に存在します。この加水分解酵素は通常、β-ガラクトシドを単糖に変換する働きがあり、老化細胞ではリソソームに蓄積しています。in-vitroで老化細胞を明らかにする簡易な測定法では、発色性ガラクトースであるX-galを使用します。その際、この基質はβ-galにより切断され青色に変化します5(PMID:20010931)。
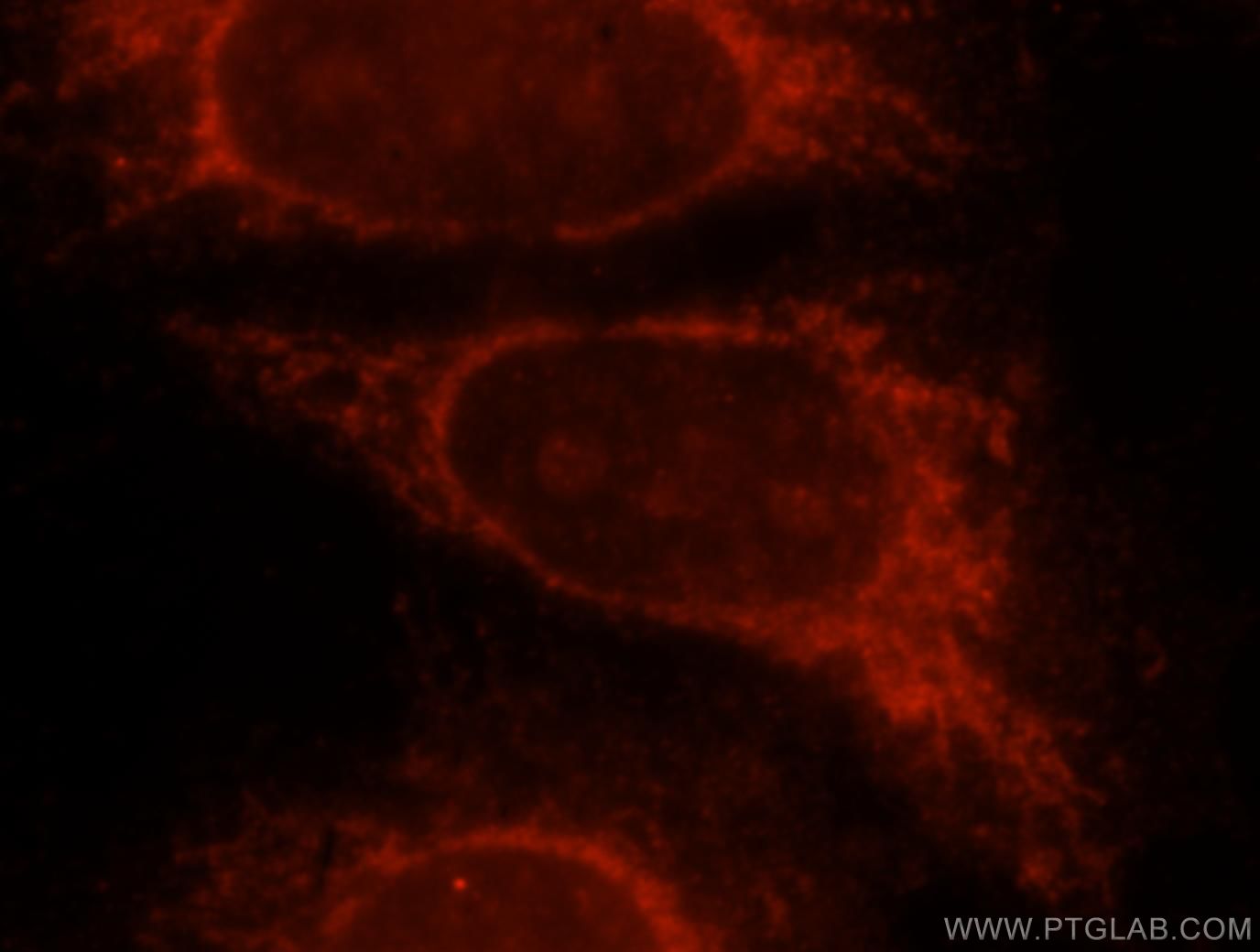
図3. 1:25に希釈したGLB1抗体(カタログ番号:15518-1-AP)と、ローダミン標識ヤギ抗ウサギIgG(赤)を用いたHeLa細胞の免疫蛍光染色の解析像。
- リポフスチン
老化細胞のリソソーム内の凝集体は、リポフスチンとして知られており、分解されなかった脂質、タンパク質、陽イオンで構成されています。これらは、Sudan Black B(ズダンブラックB/スーダンブラックB)由来の色素を使用して、組織内およびin vitroで検出することができます9,6(PMID:30261683、24848057)。
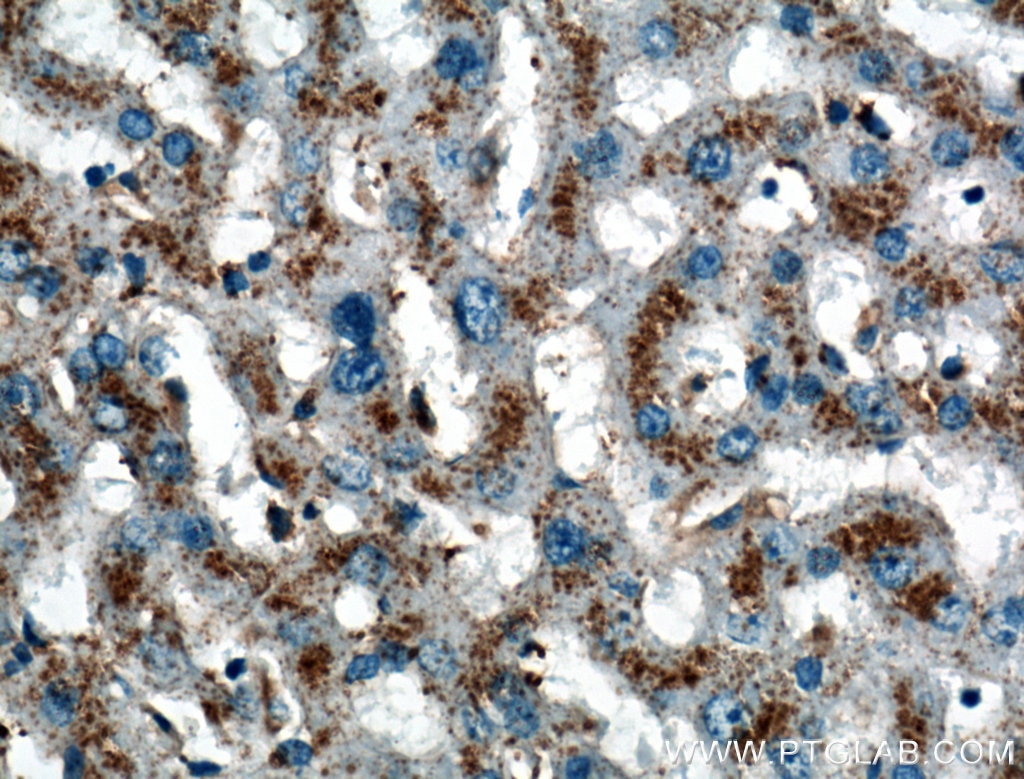
図4. 1:200で希釈したLIMPII抗体(カタログ番号:27102-1-AP)を用いたパラフィン包埋ヒト肝組織スライドの免疫組織化学染色の解析像(40倍レンズを使用)。
- 細胞老化随伴分泌現象(SASP)
老化時の遺伝子発現の変化により細胞老化随伴分泌現象(SASP)が生じます。その現象ではIL-6等のインターロイキン、IL-8等のケモカイン、VEGF等の増殖因子といった、多くの可溶性因子の発現が増加します7(PMID:27797960)。また、一酸化窒素等の特定の非可溶性因子も増加します。SASPは、周辺の組織に影響を及ぼし、近傍の細胞の老化を誘発する可能性があります。
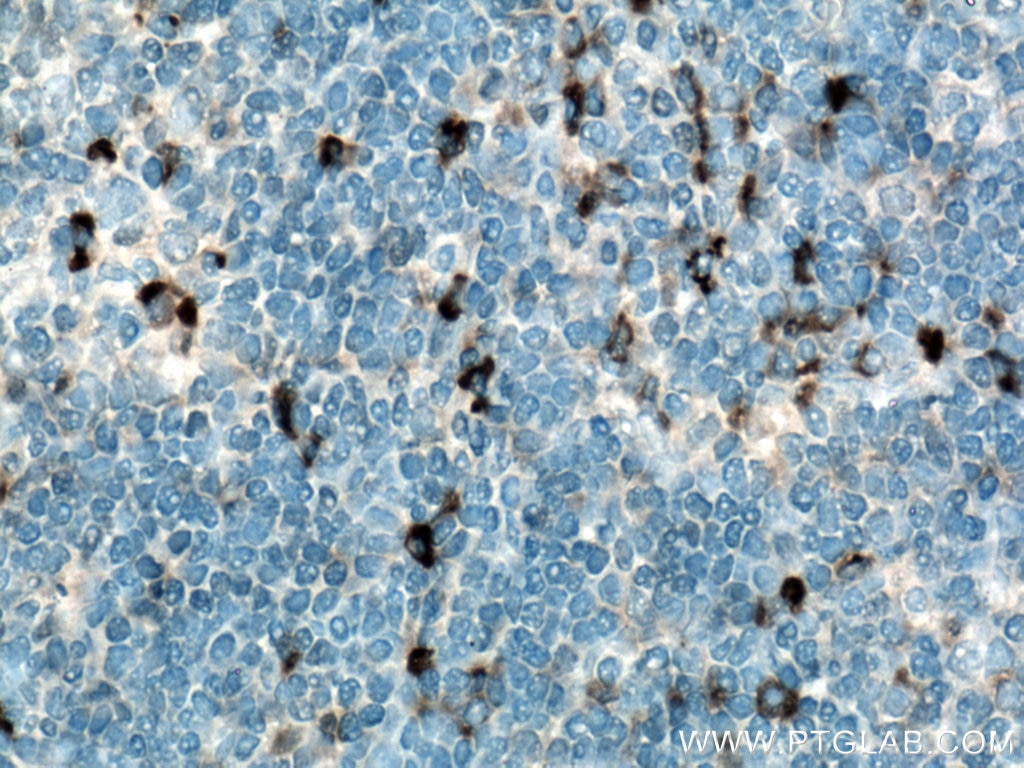
図5. 1:200で希釈したIL-6抗体(カタログ番号:21865-1-AP)を用いたパラフィン包埋ヒト扁桃炎組織スライドの免疫組織化学染色の解析像(40倍レンズを使用)。Tris-EDTA緩衝液(pH9)で熱処理し抗原賦活化した試料を使用。
異なるバイオマーカーを互いに組み合わせて使用することは、老化現象を実証するための最良の方法です。同時に、疾患研究として老化現象を調査することは、老化過程の様々な役割を網羅し、この分野の研究を統合する機会を提供します。
表1.老化の識別に使用されるタンパク質マーカー
|
タンパク質名 |
機能 |
細胞内局在 |
カタログ番号 |
|
DNA損傷応答(DDR)マーカー |
|||
|
クロマチンのヌクレオソーム |
核 |
||
|
腫瘍抑制因子と細胞周期調節因子 |
|||
|
細胞のG1期からS期への進行抑制 |
核・ 細胞質 |
||
|
G1期における細胞周期進行の制御 |
主に核 |
||
|
G1/Sチェックポイントで細胞周期を停止させ、DNA修復機構を活性化する |
核・ 細胞質 |
||
|
リソソーム関連タンパク質 |
|||
|
β-galactosideを単糖へ変換 |
リソソーム |
||
|
細胞老化随伴分泌現象(SASP)マーカー |
|||
|
炎症促進性または抗炎症性サイトカインと考えられている |
細胞外 |
||
|
走化性、貪食性、血管新生の誘導 |
細胞外 |
||
|
血管新生、脈管形成、内皮細胞増殖の誘導 |
細胞外 |
||
参考文献
- Hayflick, L. & Moorhead, P. S. The serial cultivation of human diploid cell strains’. exp. cell res. 25, 585–621 (1961).
- Muñoz-Espín, D. & Serrano, M. Cellular senescence: from physiology to pathology. Nat. Publ. Gr. 15, (2014).
- Campisi, J. Aging, Cellular Senescence, and Cancer. Annu. Rev. Physiol. 75, 685–705 (2013).
- Rufini, A., Tucci, P., Celardo, I. & Melino, G. Senescence and aging: the critical roles of p53. Oncogene 32, 5129–5143 (2013).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J. & Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nat. Protoc. 4, 1798–806 (2009).
- Van Deursen, J. M. The role of senescent cells in ageing. Nature 509, (2014).
- Oubaha, M. et al. Senescence-associated secretory phenotype contributes to pathological angiogenesis in retinopathy. Sci. Transl. Med. 8, 362ra144 (2016).
- Coppé, J.-P., Desprez, P.-Y., Krtolica, A. & Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annu. Rev. Pathol. 5, 99–118 (2010).
- Kritsilis, M. et al. Ageing, Cellular Senescence and Neurodegenerative Disease. Int. J. Mol. Sci. 19, (2018).

