ELISAに適した抗体とは?正確性・信頼性を高める抗体選定と検証法
Nerea Gómez de San José著(博士、タンパク質バイオマーカー研究者)
抗体はライフサイエンス研究で最も幅広く使用されている免疫アッセイ用試薬の1つですが、抗体を使用する際には「交差反応性」や「非特異性」といった課題に直面することがあります。実際に、市販されている抗体の特異性に関する懸念は複数の研究で指摘されており(1-4)、適切な抗体の検証法(バリデーション)がより重要視されるようになっています。
本稿で話題とする「ELISA法(Enzyme-linked immunosorbent assay)」は、重要なアッセイ法の1つであり、生体試料中(血清、血漿、細胞培養上清、細胞・組織ライセート等)に含まれる標的タンパク質の定量のために広く利用されています。ELISA法には、直接・間接ELISA法、競合ELISA法、サンドイッチELISA法等のいくつかの形式があります。その中でも、標的タンパク質に結合する2種類の抗体(抗体ペア)を利用したサンドイッチELISA法は、感度と特異性の両面において優れた手法であり、市販キットの種類も豊富であることから、最も頻繁に使用されるELISA法の形式です。サンドイッチELISA法を用いた実験の成否は、使用する抗体ペアの特異性と親和性に大きく依存します。そのため、試薬メーカーや研究者自身が、新たにサンドイッチELISA法を利用したキットや実験系を構築する際には、抗体の選定と検証法がその正確性と信頼性を確保するうえで極めて重要となります。
本稿では、ELISAにおける抗体検証法の重要なポイントを解説し、アッセイの最適化に向けて、実践的かつ包括的なガイドを提供します。
抗体の検証法(バリデーション)
ELISAにおける抗体の検証法(バリデーション)は、実験系の信頼性を確保するうえで欠かせません。検証では、以下の4つの観点が特に重要となります。
- 特異性(Specificity):抗体が標的抗原のみに結合し、他のタンパク質・物質と結合しないこと
- 感度(Sensitivity):低濃度の抗原をどの程度まで検出できるかを明らかにすること
- 再現性(Reproducibility):異なる実験やラボ間で同じアッセイを実施し、一貫性のある結果が得られること
- 正確性(Accuracy):対象とする抗原を正確に定量できること
これまでに抗体のアプリケーションごとの再現性を確保するためのガイドラインは、複数の委員会や団体によって策定されています。特に2016年、Uhlenらの提唱により「抗体検証法の5本柱(five pillars for antibody validation)」が再現性を重視した戦略として示されました。このガイドラインには以下の5つの検証戦略が含まれます。
抗体検証法の5本柱
- オーソゴナル/直交的検証法(Orthogonal strategies)
抗体ベースではない方法(例:MS解析等)と抗体ベースの方法によって得られたそれぞれの結果を比較検証します。 - 独立した抗体による検証法(Independent Antibody strategies)
同じ標的タンパク質に対して、重複しないエピトープを持つ異なる抗体を使用し、結合活性・結果を比較します。 - 遺伝学的手法による検証法(Genetic strategies)
標的タンパク質を発現する遺伝子のノックアウトやノックダウンモデルを用いて、抗体が標的タンパク質に特異的に結合していることを確認します。 - 標的タンパク質の発現による検証法(Target Protein Expression strategies)
特定のタグを融合した標的タンパク質を発現させ、エピトープタグに対する抗体シグナルと比較します。 - 免疫捕捉と質量分析による検証法(Immunocapture and Mass Spectrometry(IMS) strategies)
免疫捕捉後に質量分析を行うことで、抗体の特異性を検証します。
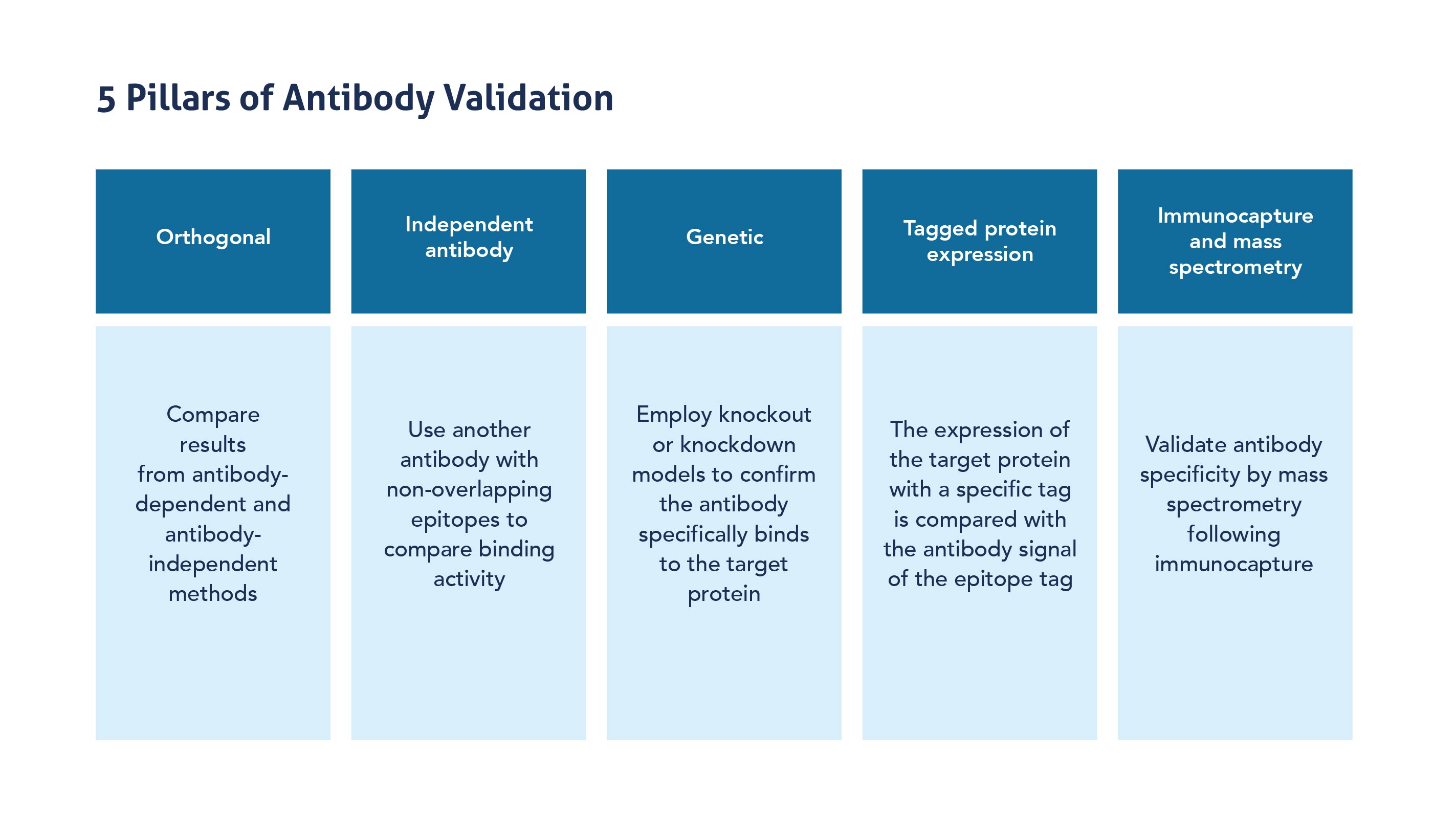
図1. 抗体検証法の5本柱
アッセイに応じた抗体検証法
抗体を利用する各種アッセイでは、アッセイごとに試料(サンプル)の前処理・調製方法が異なるという点に注意を払う必要があります。
ELISAやフローサイトメトリー解析の場合、一般的に未変性のタンパク質(立体構造を保ったネイティブタンパク質)を対象として測定します。一方、ウェスタンブロットや免疫組織化学、免疫細胞化学の場合、サンプルの加熱・固定・賦活化処理が施されるため、部分的または完全に変性した状態のタンパク質が対象となります。このようなタンパク質の変性状態やコンホメーション(立体構造)の違いにより、抗体のエピトープへのアクセス性に違いが生じます。そのため、あるアッセイでは良好に機能する抗体が、別のアッセイではうまく機能しない場合があります。
このように、抗体を利用するアッセイは様々な要因が複雑に関与するため、すべてのアプリケーションに共通して適用できる統一された評価基準を設けることは困難です。したがって、各アプリケーションや実験条件に応じて、適切な抗体検証法を使い分けることが重要となります。
ELISA法と抗体検証
ELISA法は、タンパク質、抗体、ペプチド、ホルモン等の様々な可溶性物質を検出するために利用されます。ELISA法にはいくつかの形式がありますが、なかでも2種類の抗体(抗体ペア、マッチドペア抗体)を利用するサンドイッチELISA法が最も頻繁に用いられています(図2)。
サンドイッチELISA法では、マイクロタイタープレートに「捕捉抗体(キャプチャー抗体)」を固相化し、サンプルを添加することで標的タンパク質を捕捉します。続いて「検出抗体」を添加し、さらに酵素標識済みの二次抗体またはストレプトアビジンを加えます。その後、基質を反応させて検出可能なシグナルを生成します。抗体ペアを使用するサンドイッチELISA法の利点は、間接ELISA法や直接ELISA法と比較して、感度および特異性の両面において優れた性能を示す点です。
サンドイッチELISA法においても、正確性と再現性を確保するために、抗体検証は極めて重要なステップです。
プロテインテックの関連製品:マッチドペア抗体
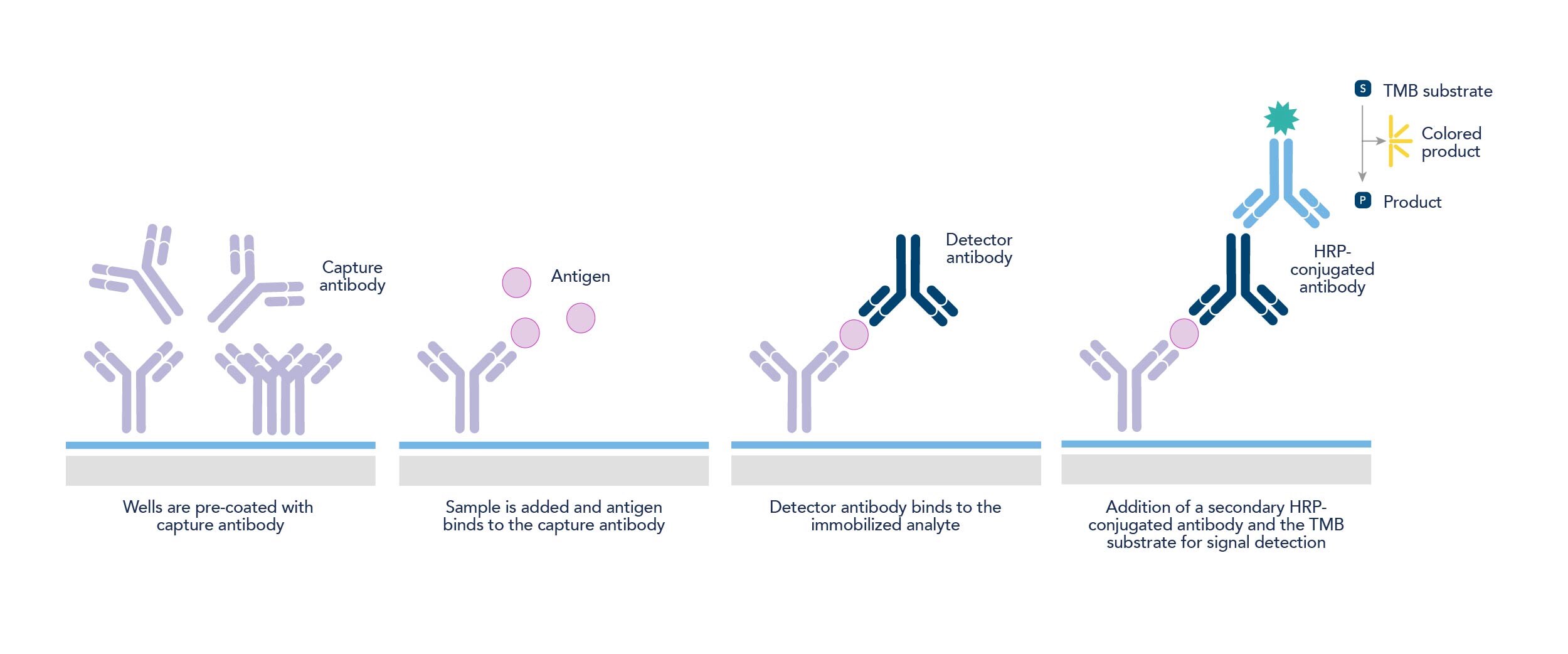
図2. サンドイッチELISAのワークフロー
抗体ペアの選定と検証時のポイント
- ターゲットタンパク質を理解する
- タンパク質の構造:ELISA用の抗体ペアは、抗原表面上の重複しない各エピトープと結合する必要があります。それぞれの抗体のエピトープが標的領域として適切かを検討するために、ターゲットタンパク質のネイティブな構造(立体構造)を把握しておくことが重要です。
- 生物学的な背景:研究対象とするタンパク質の役割や発現状況を考慮して、ELISA測定に供する生体試料の種類、コントロールや測定範囲・感度等のアッセイ条件を検討します。
- 翻訳後修飾(PTM)・アイソフォーム・切断産物の存在:抗体結合に影響を及ぼす可能性のあるタンパク質修飾の有無、アイソフォームの発現、切断等によるプロセシング(成熟や分泌)の過程を確認する必要があります。
- コントロール実験を計画・実施する
- 発現の確認:使用する生体試料中でターゲットタンパク質が確実に発現していることを確認します。これは、文献やデータベースによる事前調査に加え、RT-PCRやウェスタンブロット等の手法を用いた実験的な検証によって行うことができます。
- コントロールの設定・検証:抗体の特異性を検証するために、可能であればポジティブコントロールとネガティブコントロールを用意して実験を行います。これには、標的タンパク質の内在的な発現量が異なる生体試料(例:組織や細胞株等)を用いたコントロールや、組換え(リコンビナント)タンパク質をスパイクインした人工的なコントロールが含まれます。
- 抗体の適合性を検証する
- 抗体の結合は、マトリックス効果(生体試料中に存在する標的物質以外の成分がアッセイ系およびその測定結果に干渉する現象)によって阻害される場合があります。マトリックス効果の影響は、試料の種類(血清・血漿、細胞培養上清、細胞・組織ライセート等)によって異なります。そのため、抗体が使用予定の試料で適切に機能するかを事前に確認しておくことが重要です。まずは、抗体メーカーが公開している検証内容が、検討予定の試料やアプリケーションと一致しているかを確認すると良いでしょう。そのうえで、添加回収試験(スパイク&リカバリー法)や希釈直線性の評価試験等を実施し、抗体が測定対象の試料に適合しているかを検証します。
─ 添加回収試験:既知濃度の標準物質(例:リコンビナントタンパク質)を実際のサンプルマトリックス(血清や血漿等)に添加(スパイク)し、どの程度正確に回収できるかを確認する試験です。
─ 希釈直線性の評価試験:生体試料を段階的に希釈し、測定値も希釈倍率に応じて直線的に減少するかどうかを確認する検証方法です。また、抗原が高濃度すぎることでシグナルが飽和または減少する「フック効果(Hook effect)」の有無も、この試験で併せて確認できます。
添加回収試験と希釈直線性の評価試験は、いずれもマトリックス効果の有無や影響の程度を確認するために用いられます。前者は、主に抗体とターゲットの結合がマトリックス中の因子によって妨げられていないかの確認に有効であり、検出の正確性を評価するための指標となります。一方、後者は、主に抗体が非特異的な成分に反応していないか、またはマトリックス成分が測定に干渉していないかの確認に用いられ、測定値が希釈倍率に応じて直線的に減少するかを見ることで判断します。両者を組み合わせて実施することで、マトリックス効果の異なる側面を補完的に評価し、アッセイの信頼性をより多角的に検証することができます。その他、必要に応じて「抗体検証法の5本柱」に従い、追加の検証試験を実施します。
- 抗体濃度の最適条件を求める
- 捕捉抗体・検出抗体の最適濃度を評価するには、チェッカーボードタイトレーション法(Checkerboard titration method)を実施してください。
─ チェッカーボードタイトレーション法:サンドイッチELISAに用いる抗体の検証の場合、キャプチャー抗体と検出抗体の濃度を段階的に変えて組み合わせ、評価し、最適な条件を見つけます。シグナル強度とバックグラウンドのバランスが最も良い組み合わせを選ぶことで、抗体の無駄な使用を避けつつ、感度の高いアッセイ系を構築できます。
構築したELISAアッセイ系の検証法
実際に開発・構築されたELISAアッセイ系で生体試料中の特性の把握と信頼性の担保のためには、以下に示す項目の検証が推奨されます。この手順はAndreassonらによる論文「A Practical Guide to Immunoassay Method Validation」で示されたガイドラインを参考にしています。
- 精度(Precision):繰り返し測定を実施した際のばらつきと再現性を評価します。
- アッセイ内精度(ラン内精度、併行精度、Within-Run / Intra-Assay Precision):1回の測定で、最低でも2点の濃度領域の試料(高濃度と低濃度)を複数回測定して、そのばらつきの程度を評価します。
- アッセイ間精度(ラン間精度、室内再現精度、Between-Run / Inter-Assay Precision):同一サンプルを異なる試験日、プレート、場合によっては測定者等の条件を変更して測定し、ばらつきを評価します。
- 感度(Sensitivity):「感度(Sensitivity)」は、文献やメーカーによって定義が異なるため注意が必要です。一般的なELISAキットでは、感度を「最小検出可能濃度(MDD:Minimum Detectable Dose)」として定義するケースが多く見られます(検出下限や検出限界とも呼ばれます)。この場合、ゼロ濃度のサンプル(ブランク = サンプル希釈液)を複数回測定し、その平均シグナルに2倍(または3倍)の標準偏差(SD)を加えた値から換算された濃度をMDDとします。MDDは、統計的にバックグラウンドと区別可能な最小のシグナル値に基づいており、MDD以上の場合は陽性シグナルとして解釈される一方で、正確な定量値であるとは限りません。これに対して、より厳密な定量性能を示す指標として「定量下限(LLOQ:Lower Limit of Quantification)」があります。LLOQの定義は複数あり、例えば「ブランクの平均+10SDのシグナル」に対応する濃度を用いる方法のほか、既知の低濃度サンプルを繰り返し測定し、精度(変動係数:%CV)や真度の基準を満たす最小濃度をLLOQとする方法もあります。つまり、MDDは「検出できるかどうか」、LLOQは「正確に定量できるかどうか」を示す指標です。アッセイの性能を評価する際は、こうした違いを理解し、適切に使い分けることが求められます。
- マトリックス効果(Matrix effect)とは、生体試料(マトリックス)に存在する物質が測定に干渉する現象を指します。マトリックス効果は試料を希釈することで軽減できます。添加回収試験と希釈直線性の評価試験を行って判断します。
- タンパク質の安定性(Protein stability):様々な温度条件(例:室温、4℃、-20℃)で保存した試料や、凍結融解を繰り返した試料中の測定対象物質の安定性を評価します。この評価は、試料の採取方法や保存条件に起因する系統誤差(特定の原因によって測定値が一方向に偏る誤差)の発生を防ぐために重要な確認事項です。
- 交差反応性の評価(Cross-Reactivity Testing):ELISAに使用する抗体を、標的タンパク質と類似した構造を持つ複数の関連タンパク質やファミリー分子に対して反応させ、交差反応性を評価します。この検証試験を実施することで、抗体がターゲット抗原に特異的でその他のタンパク質の類似エピトープに結合しないことを確認できます。BLAST ®等のオンラインで利用できる相同性検索ツールは、交差反応性を確認する際の補助ツールとして非常に役立ちます。
ELISAのトラブルシューティング
十分な検証試験が実施されたELISA系であっても、実際の測定時に問題が発生する場合があります。以下に、よくあるトラブルとその対処法を紹介します。
- 非特異的結合
- 問題点:バックグラウンドシグナルが高くなる/非特異的結合が認められる。
- 解決法:ブロッキング条件や洗浄条件を最適化してください。
- 低感度
- 問題点:ターゲット抗原を十分に検出できない。
- 解決法:使用するすべての試薬類はアッセイを実施する前に30分程度かけて必ず室温に戻してください。また、ピペットのチップの先端がウェルの底に直接触れないように、ピペットの角度を斜めにして試薬を添加するようにしましょう。試料を希釈しすぎている可能性もあるため、試料濃度が検出範囲内におさまるように段階希釈によって最適な希釈倍率を検討してください。
- 結果にばらつきがある/結果が安定しない
- 問題点:反復測定やアッセイごとに結果がばらつく。
- 解決法:まずは、プロトコールが標準化されているかを確認してください。加えて、試薬ロットが一致しているか、一貫性に問題ないかを見直しましょう。実験室内やインキュベーター内の温度等、環境条件を厳密に制御することも重要です。
まとめ
抗体の検証は、ELISA実験系の信頼性を高めるうえで欠かせない重要なステップの1つです。抗体検証法に関するガイドラインを活用し、アプリケーションに応じた適切な検証戦略を実践することで、実験結果の精度と再現性を大きく向上させることができます。
参考文献
- M Herrera, et al. Lack of specificity of commercial antibodies leads to misidentification of angiotensin type 1 receptor protein. Hypertension. 2013 Jan;61(1):253-8.
- A Schonbrunn. Editorial: Antibody can get it right: confronting problems of antibody specificity and irreproducibility. Mol Endocrinol. 2014 Sep;28(9):1403-7.
- S Andersson, et al. Insufficient antibody validation challenges oestrogen receptor beta research. Nat Commun. 2017 Jun 15:8:15840.
- R A Kahn, H S Virk, P S McPherson. Heed a decade of calls for antibody validation. Nature. 2023 Aug;620(7974):492.
- M Uhlen, et al. A proposal for validation of antibodies. Nat Methods. 2016 Oct;13(10):823-7.
- U Andreasson, et al. A Practical Guide to Immunoassay Method Validation. Front Neurol. 2015 Aug 19:6:179.
プロテインテックはELISAに関連する様々な製品を取り揃えています。
プロテインテックの関連製品:マッチドペア抗体


