ヒントとコツ | 質量分析実験を成功させるために
質量分析実験でよく起きる問題に対処するための、トラブルシューティングガイドをご紹介します。
質量分析法は、創薬の基礎研究や応用研究でよく用いられている手法です。単純な組成の混合物に含まれる化合物の同定から、プロテオミクス等のより複雑な実験系の解析にいたるまで、その応用範囲は多岐にわたります。
プロテオームとプロテオミクス
プロテオームは、生物内のタンパク質全体を指します。プロテオミクスは、環境の影響、自律的変化(例:分化、細胞死)、細胞型、細胞コンパートメント、細胞周期のステージ等の状況下におけるプロテオーム動態の研究が必要とされる学問分野です(1)。
質量分析法を用いたプロテオーム研究により、タンパク質の発現量、アイソフォーム、修飾(ユビキチン化、SUMO化、リン酸化)等の変化を明らかにすることができます。In vivoでのタンパク質クロスリンク(共有結合性架橋剤、または非共有結合性架橋剤を使用します)によって、今までは計画的な変異導入やハイブリダイゼーション等による研究でしか解明することができなかった、特定のタンパク質‐タンパク質相互作用の詳細な知見を得ることができます(2、3)。
質量分析法は、多くの生物学的な疑問を解決する新たな機会を提供してくれます。しかし、最新の質量分析法は感度が高く、複雑であることから、サンプル調製やデータ解析に慎重を要します。
質量分析実験を開始する前に考慮すべき、いくつかの点について
• 実験の背景にある生物学上の疑問点とは何か、質量分析法がその疑問を解決できる可能性はどの程度あるか?
• どのような種類のサンプルを使用するのか?
• 目的のタンパク質の存在量はどの程度か、目的のタンパク質の検出はどの程度容易か?
• タンパク質修飾はどの程度安定か、タンパク質分解をどのように防止するか?
• 検出の妨げとなるサンプルのコンタミネーション(例:ケラチン、ポリマー)をどのように防止するか?
• 実験に含める必要のあるコントロールには何を使用するか?
• 検出に最適なサイズのペプチドフラグメントを得るために、どの種類の酵素および酵素消化方法を選択するか?
• どのタイプのソフトウェアで解析を実施するか?
質量分析のデータ解析で重要となる4つのパラメーター
A. シグナル強度
シグナル強度は単一ペプチドの存在量はどの程度か、すなわち、どの程度検出されたかを示す直接的な尺度です。この値は、元のタンパク質、ペプチドのサイズ、その「飛行する」能力に影響を受けます。注記:すべてのペプチドが質量分析装置の中を「飛行」できるとは限りません。ペプチドがイオン化しなかったり、生成イオンが不安定でフラグメント化したりすると、検出することはできません。
B. ペプチド数
ペプチド数とは、同一のタンパク質に由来する異なる種類の検出ペプチドを指します。ペプチド数が少ないということは、タンパク質の存在量が少ないか、あるいは消化で得られたペプチドが検出に最適なサイズではない(小さすぎる、または大きすぎる)ということを意味します。この場合、消化時間を適宜調節する、あるいは代替の酵素を検討する必要があります。
C. カバレッジ(Sequence Coverage)
カバレッジはペプチド数と直接的に関連し、元のタンパク質のうち検出ペプチドがカバーする割合を指します。あまり複雑でないサンプルの良好なカバレッジは40~80%です(主に精製タンパク質を取り扱う場合)。この値は、消化酵素認識部位数や酵素消化後のペプチド長に依存します。より複雑なプロテオームサンプルの場合、タンパク質のカバレッジが1~10%の範囲であればタンパク質の同定をすることができます。
D. 「P値」・「Q値」・「スコア」
ペプチドの結果を確認する/同定するには、統計的有意性解析による検証が必要です。使用するソフトフェアに応じて、統計値はP値/Q値、スコアで示され、有意水準(P値の場合、<0.05がよく用いられます)を満たさなければなりません。
P値:ペプチドの同定結果が「偽陽性」である確率
Q値:FDR(FDR:False Discovery Rate=実際のシグナルに有意差がないのに有意であると判断される確率、すなわち棄却されたすべての帰無仮説に「第1種の過誤」が含まれる確率)を加味して補正調整したP値
スコア(MASCOTソフトウェアで用いられる値):得られた質量データが特定のデータやペプチド等にマッチする確率を換算した値。ペプチド同定の可能性を確率事象(random event)であるとして取り扱います。
質量分析のトラブルシューティング—シグナルが検出されない—
Q:タンパク質が発現していなかった?
A:インプットサンプル(例:細胞回収直後のサンプル)をウェスタンブロットで確認しましょう。
参考:プロテインテックのアプリケーションサポート(Western blot protocol)
Q:実験の操作中(サンプル調製時)に目的タンパク質のロスがあった?
A:各実験のステップごとにサンプルの一部を取り分けておき、得られるタンパク質がサンプル由来のタンパク質であるか確認することを習慣化しましょう(目的タンパク質の有無や逸脱をウェスタンブロット(WB)により検証します)。
Q:サンプル調製のステップでタンパク質の分解が生じた?
A:様々な理由により、タンパク質には分解しやすいものが存在します。サンプル前処理の段階で、追加のプロテアーゼ阻害剤カクテル(アスバラギン酸、セリン、システインプロテアーゼ等の幅広いプロテアーゼに対して有効なもの)をすべてのバッファーに添加しておくことをおすすめします(これらのプロテアーゼ阻害剤はトリプシン処理前に確実に除去しておくことを忘れないようにしましょう)。また、EDTAフリーのカクテルを使用してください。PMSF等が良いでしょう。
Q:実験のいずれかのステップで大幅にサンプルをロスしてしまった?
A:存在量の少ないタンパク質は、サンプル前処理の段階で失われる可能性があることと、存在量の多いタンパク質と近いm/zである場合は検出できない可能性があります。実験をスケールアップする、細胞分画プロトコールを使用して相対的な目的タンパク質濃度を高くする、またはIPを使用して低濃度のタンパク質を濃縮するといった操作を実施してください。
Q:もしかしたら「検出を免れたペプチド」がある?
A:ペプチドのサイズが不適切な場合(検出するにはペプチド長が長すぎる、または短すぎる場合)、タンパク質サンプルの配列内にプロテアーゼ認識部位が不足している/過剰に存在する、または酵素消化時間が長すぎた/短すぎたことが原因である可能性があります。プロテアーゼの種類や、酵素消化時間を変更してみましょう。二重消化も選択肢の1つに挙げられます(2種類の異なるプロテアーゼを使用して酵素消化を実施します)。
5つの究極のヒント
ヒント1:
実験を始める前に:タンパク質の存在量、調節機構、発現プロファイルを確認してください。複数のデータセットでプロテオーム解析をする場合:細胞周期の調節機構、細胞株の特性を確認しておきます(例:通常、がん細胞株は転写調節機構、シグナル伝達経路が正常に機能しておらず、未制御に増殖します)。
ヒント2:
フィルターチップ、使い捨てのピペット、HPLCグレードの水を使用します。プラスチック器具や溶液のオートクレーブ、ガラス製品洗浄用の洗剤の使用を避けてください。
ヒント3:
バッファー組成がすべて適合しているか確認します。プロテアーゼ阻害剤、界面活性剤、EDTA、還元剤等の適合性、バッファーの塩濃度やpHを確認してください。
ヒント4:
すべてのタンパク質サンプルを低温に保ってください(4℃:実験操作時/-20から-80℃:保管時)。
ヒント5:
ウェスタンブロット/クマシー染色によって、実験の各ステップを常にモニタリングしてください。
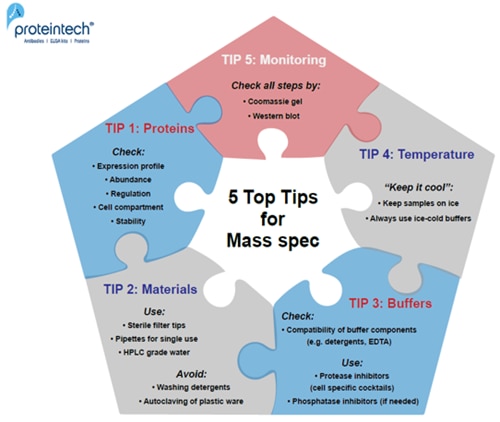
図1. 質量分析実験を成功させるための5つの究極のヒント

