ヒントとコツ | 低分子量タンパク質のウェスタンブロット解析
低分子量タンパク質をウェスタンブロットで解析する際のポイントを解説します。
通常のSDS-PAGEおよびウェスタンブロット(WB)法は、分子量(MW)が約30キロダルトン(kDa)~250kDaの範囲の幅広いサイズのタンパク質を調べることができる確立された手法です。しかし、本手法で検出可能とされる限界分子量域付近では、目的物質が綺麗に分離されない、シグナルが減衰する、目的バンドが全く認められないといった制限に煩わせられます。低分子量タンパク質(通常、分子量20kDa未満のタンパク質を指します)は、分離が悪く、メンブレンへの保持力が低い傾向にあります。したがって、低分子量タンパク質を「一般的」なSDS-PAGEおよびウェスタンブロットのプロトコールで検出するのは簡単ではありません。検出不可能という訳ではなく、プロトコールでいくつかの箇所を最適化すれば、SDS-PAGEやその後のウェスタンブロットを実施する際に、低分子量タンパク質の分離を改善し、保持力を高め、良好な結果を得ることが可能です。
トリシン系を試してみる
前項で言及した「一般的」なSDS-PAGEに使用されるポリアクリルアミドゲルは、均一グリシン‐トリスゲル(以降「グリシンゲル」)です。通常、アクリルアミドの混合量(%T)を調節することによって、グリシンゲルは30kDa~250kDaの分子量範囲のタンパク質を分離するための理想的なゲルとなります(250kDa付近の分子量の大きいタンパク質を分離する場合は良好な分離のために約8%のアクリルアミド濃度のゲルを使用しますが、分子量が小さくなるにしたがって最大で16%程度までアクリルアミドの添加量を増やします。30kDa付近の分子量の小さいタンパク質であれば18%のゲルを使用する場合もあります)。30kDa未満のタンパク質をSDS-PAGEで分離する場合は、トリス‐トリシン系アクリルアミドゲル(以降「トリシンゲル」)を使用することによって目的タンパク質のバンドを確認できる可能性が劇的に向上します。グリシンゲルで目的タンパク質の予想分子量付近に「単一」バンドに見える不明瞭なシグナルが確認された場合、トリシンゲルを使用すると実際には分子量が明確で良好に分離した複数の個別のバンドを確認できることがあります。この違いは、pHとアクリルアミド濃度(%T)が同一のグリシンゲルとトリシンゲル間であっても観察されます(例:一般的なpH6.8~8.8の15%グリシンゲルと15%トリシンゲルを比較)。
15%トリシンゲルの組成は、プロテインテックのウェスタンブロット完全ガイド[PDF]に掲載しています
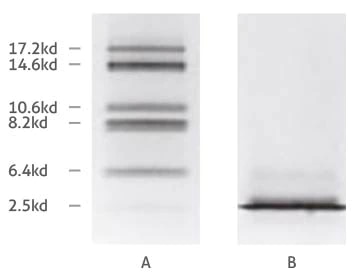
ミオグロビンフラグメントの(A)トリシン系SDS-PAGE、および(B)グリシン系SDS-PAGEによる分離の比較(Schägger and von Jagow, 1987より引用)
グリシンゲルとトリシンゲルの分離能力の違いは、グリシン化合物とトリシン化合物のpK値やイオン移動度等の特性が大きく異なることに起因します。本稿では詳述しませんが、基本的には、トリシンが低分子量タンパク質の分離に最適な理由は、グリシンとは異なる形でタンパク質を「スタック(濃縮)」する作用のためと考えられます。走者がレース開始時にスタートラインに並ぶように、タンパク質を均一なバンドに濃縮することがスタッキングゲル層(濃縮ゲル層)の目的です。濃縮されることでタンパク質は分離ゲル層へ同時に侵入します(タンパク質が濃縮されず一部が先に泳動してしまうと、バンドがスメア(不明瞭)になることがあります)。トリシン系のスタッキングゲル(濃縮ゲル)の場合、最初に濃縮ゲル中で濃縮できる分子量の上限値(ゲル中で濃縮できる最も大きな分子量のタンパク質)を下方にシフトさせ、その分子量は30kDaよりも小さくなります1。30kDaを超える分子量のタンパク質は、分離ゲル層に到達する前に30kDa前後のタンパク質と分離しているため、濃縮ゲル層と分離ゲル層の境界に分子量の異なるタンパク質が過剰にロードされる状態を回避し、分子量の最も小さなタンパク質を含む濃縮タンパク質の分離が適切に開始されます1。また、トリシンのイオン移動度が高いということは、添加するアクリルアミドの量を減らしても、アクリルアミド濃度の高いグリシンゲルと同じ程度に低分子量タンパク質の分離を実施することが可能であることを意味します。例えば、アクリルアミド濃度を少なくした15%トリシンゲルを使用して5~20kDaのタンパク質を分離することができます。しかし、5kDa未満のタンパク質の場合はどうでしょうか—この場合は、ゲルを作製する際に6M尿素を加えると小さなタンパク質の分離能がさらに高まります2。5kDa未満のタンパク質を分離したい場合は、尿素を添加したゲルの使用を推奨します。
タンパク質の転写
低分子量タンパク質を適切に分離するだけでなく、タンパク質の転写段階でも注意すべき事項があります。低分子量タンパク質は、「over transfer(過剰転写)」になりやすく、転写時の移動速度が速く、転写メンブレンへ保持されにくいことからサンプルロスが生じます。
メンブレンの選択と孔径(ポアサイズ)
ほとんどのラボでは、ウェスタンブロットのメンブレンを選択する際にニトロセルロースまたはPVDF(ポリフッ化ビニリデン)のどちらか一方を好んで使用する場合があります。PVDFはニトロセルロースに比べ、タンパク質結合能が高く、PVDFのタンパク質結合能は170~200µg/㎠、ニトロセルロースのタンパク質結合能は80~100µg/㎠です3。低分子量タンパク質の場合は、ニトロセルロースを推奨している記載もありますが3、プロテインテックではタンパク質結合能の違いから通常PVDFを選択して良い結果を得ております。こちらの記事(biocompare.com)は、ウェスタンブロット用のメンブレンを選択する際に考慮すべきいくつかの検討事項について解説しており、PVDFとニトロセルロースメンブレンの両方の微細構造の画像を掲載しています(PVDFのタンパク質保持能がわずかに高いことを説明する一環として掲載されています)。
どちらのメンブレンを選択する場合でも、様々な孔径のメンブレンが販売されていることに留意してください。いずれも0.45µm、0.2µm、0.1µmのメンブレンが販売されています。孔径の小さいメンブレンを選択すると、分子量の小さい目的タンパク質を良好に転写することができます—孔径0.2µmのメンブレンであれば、20kDa未満のタンパク質の取り扱いには十分です。プロテインテックのラボでは、低分子量タンパク質の転写に、メルクミリポア社のImmobilon PSQ(merckmillipore.com)のPVDFメンブレンを使用しています。
転写条件
低分子量タンパク質を扱う場合、メンブレンの選択に加えて、転写システム、転写時間、温度、バッファー組成等のその他の要因も転写に影響を及ぼします。低分子量タンパク質では、ウェット式転写システムよりもセミドライ式転写システムで良好な結果を得られる傾向にあります(おそらく、単にセミドライシステムは転写効率が高く短時間で転写が完了するため、過剰転写の影響を受けにくいと考えられます)。しかし、セミドライ転写システムは再現性に問題があるという点に留意してください(ただし、目的タンパク質の分子量が小さい場合、それほど問題はないでしょう)。
低分子量タンパク質の場合、転写時間と電圧(設定によってはアンペア数)に関しては、短い/低い方が良好な結果が得られる場合が多い傾向にあります。これらの条件をどの程度調整する必要があるかは、使用しているシステムのメーカーと型式によって異なります。装置の説明書に記載されている、30kDa未満のタンパク質に推奨される転写時間と電圧を調べてみましょう。設定条件が記載されていない場合でも、メーカーのウェブサイトに情報が掲載されている場合があります。
その他のポイント
電気泳動中のサンプル移動度を確認する際の目安に、サンプルローディングバッファーにブロモフェノールブルー(BPB)を使用している場合、一部のタンパク質は色素よりも先に泳動することに留意してください。
転写を開始する前に、ゲルをSDSフリーバッファー(または単にH2O)に5分間浸漬することも可能です。この操作を行うと小さなタンパク質やタンパク質フラグメントを負に帯電させるSDSが除去され、低分子量タンパク質のウェスタンブロットメンブレンへの吸着効率が向上します。
本稿は以上となります。それでは、良好な結果が得られることを願っております!
参考文献
2. H Schägger, Tricine-SDS-PAGE, Nature Protoc. 2006;1(1):16-22.
3. The Protein Man’s Blog, PVDF or Nitrocellulose – Which Membrane is Best? Nov 12, 2014:http://info.gbiosciences.com/blog/bid/203026/PVDF-or-Nitrocellulose-Which-Membrane-is-Best

