Split蛍光タンパク質テクノロジー
クロモテックのGFP-Trap®は、様々なSplit GFPバリアントを利用した各種アッセイで使用実績を重ねています。
クロモテック(ChromoTek)の研究者であるMichael Metterlein博士とChristian Linke-Winnebeck氏は、Split蛍光タンパク質(Split Fluorescent Protein、split-FP)技術分野の開発状況に関する包括的な解説[PDF]を公開しています。この解説には、例えばタンパク質間相互作用の研究等において、Split蛍光タンパク質技術を最大限に活用するために、クロモテックのNano-Trapがどのように使用されたかという事例が取り上げられています。特に、クロモテックのGFP-Trap®は、様々なSplit GFPバリアントを利用した各種アッセイで使用実績を重ねています。Split蛍光タンパク質アッセイ(※)の種類には、蛍光タンパク質の自己相補(self-complementation)法、BiFC(bimolecular fluorescence complementation、二分子蛍光補完)法、TriFC(trimolecular fluorescence complementation/tripartite fluorescence complementation、三分子蛍光補完)法、BiCAP(bimolecular complementation affinity purification、二分子相補アフィニティ精製)法等があります。
※ Split蛍光タンパク質アッセイ:分割した蛍光タンパク質フラグメントを相互作用するタンパク質にそれぞれ融合して実施される解析手法です。相互作用するタンパク質同士が結合すると、融合した蛍光タンパク質フラグメントが近接するため、活性型の蛍光タンパク質が再構成されます。蛍光タンパク質のフラグメントから完全な蛍光タンパク質に再び会合する仕組みは、タンパク質補完(fluorescence complementation)として知られ、BiFC(二分子蛍光補完)法等の技術が開発されています。GFP-Trap®、mNeonGreen-Trap、RFP-Trap®は、再構成された完全な蛍光タンパク質と結合するため、これら実験の生化学的検証を行うための研究ツールとなります。例えば、GFP-Trap®は、GFP1-7やGFP8-11といった一般的な分割フラグメントには結合せず、再構成された完全なGFPタンパク質と結合します。
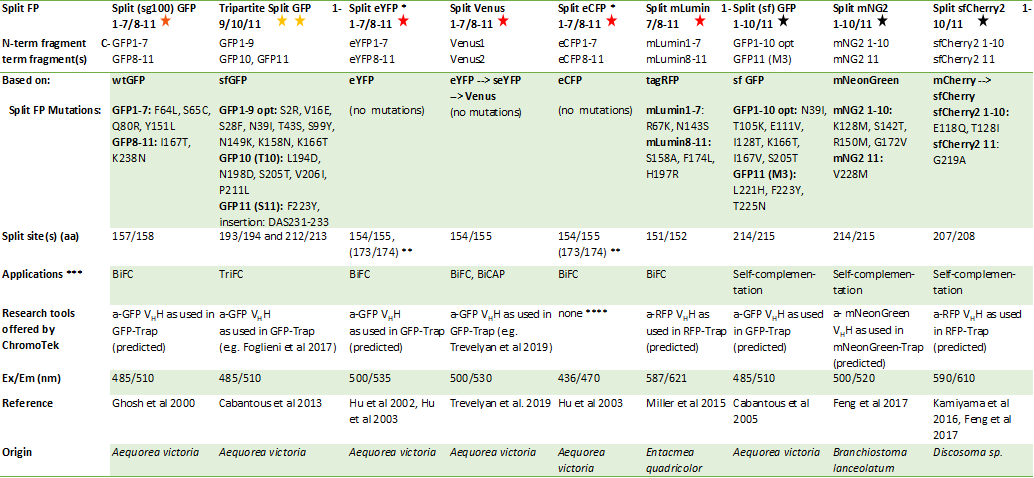
下記の表には、一般的に用いられるSplit蛍光タンパク質(Split FP)の概要がまとめられています。各Split FP名に続く数字は、FPフラグメントに含まれる各βストランド(βシートを構成するポリペプチド鎖)の番号を指します。Split FPの分割部位は、表下に掲載するGFPタンパク質の二次構造図に色付きの星印で示しました。
GFPの二次構造とGFPバリアントの詳細
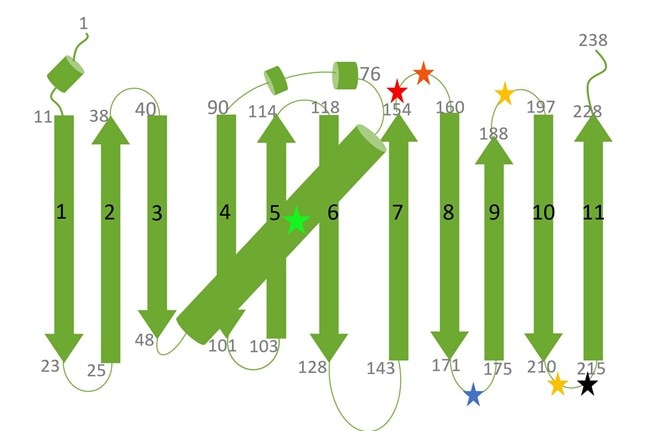
GFP(またはGFPバリアント)に存在する11のβストランドと中心部のαヘリックスを示しています。黒で示した数字は各βストランドの番号を指し、灰色で示した数字はβストランドの開始アミノ酸残基(aa)と終了アミノ酸残基を指します。GFPバリアントの蛍光発色団はαヘリックス中央部に緑色の星印で示しています。赤色、橙色、黒、黄色の星印は、各Split蛍光タンパク質バリアントにおけるβストランド間の分割部位を示しています(表に示した星印の色をご参照ください)。