ウェスタンブロットに使用される酵素:適切なツールの選択
ウェスタンブロット(WB)に役立つ2種類の酵素:ホスファターゼとグリコシダーゼ
ホスファターゼ
まずはホスファターゼから見てみましょう。シグナル伝達経路の研究において、タンパク質のリン酸化と脱リン酸化はいたるところで起こります。プロテインキナーゼはタンパク質リン酸化を触媒し、ホスファターゼは脱リン酸化を触媒します。
リン酸化タンパク質のWB解析では、予想される分子量の近辺に、2つの近似バンドが認められることがよくあります。分子量が大きい方のバンドがリン酸化された目的タンパク質であるかどうかを確認するために、ホスファターゼが使用されます。(下側のバンドではなく)上側のバンドの消失または減弱は、上側のバンドが標的タンパク質のリン酸化型であることを示しています。
プロテインテックでは、リン酸化タンパク質を標的とする抗体の特異性を検証するために、常にホスファターゼ処理を行っています。その一例が、リン酸化RIPK1(Ser161)モノクローナル抗体(カタログ番号:66854-1-Ig)です。下記の検証データ(図1)では、ホスファターゼ処理後に複数の細胞ライセート中のシグナルが消失しました。
|
図1. 種々の細胞ライセートをSDS-PAGE後、Phospho-RIPK1 (Ser161) 抗体(カタログ番号:66854-1-Ig、希釈倍率1:5000)を使用し、室温で1.5時間インキュベーションしてWBを実施した。右(λ-PPase treated):ブロッキング操作の前にλプロテインホスファターゼ(λ-PPase、500U)を使用して、37℃で1時間処理した細胞ライセート。 左(Untreated):未処理の細胞ライセート。 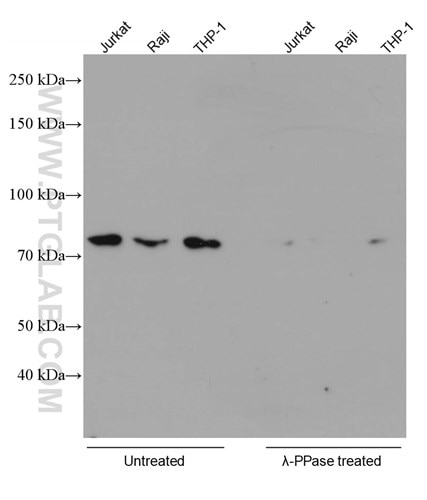 |
注意すべき点として、市販されているホスファターゼの多くは、lysis bufferによって失活します。そのため、実験で使用する前にメーカーに確認することをおすすめします。
グリコシダーゼ酵素
次に、グリコシダーゼについて見てみましょう。WBを実施すると、計算上の分子量よりもはるかに大きい分子量を示すタンパク質に遭遇することがあります(膜タンパク質に多い)。この不一致の原因の1つとして考えられるのは、糖鎖修飾です。この仮説を検証するには、グリコシダーゼ酵素を使用します。グリコシダーゼ処理後に分子量が計算分子量まで小さくなった場合、目的タンパク質は糖タンパク質である可能性が高いと考えられます。
プロテインテックでは、糖タンパク質を標的とする抗体を検証するために、グリコシダーゼによる検証を実施しています。CD2モノクローナル抗体(カタログ番号:60005-1-IG)を例に挙げると、CD2は、351残基のアミノ酸で構成されており、計算上の分子量は39kDaです。しかし、グリコシル化CD2は約50kDaに変化します。この乖離がグリコシル化によるものであることを確認するために、タンパク質からアスパラギン結合型のグリコシル基を切断するグリコシダーゼPNGase Fを使用しました。下に示したものは、Jurkat細胞を使用した実験結果です(図2)。PNGase F処理すると、標的タンパク質が計算上の分子量付近まで移動しています。
|
図2. :Jurkat細胞ライセートをSDS-PAGE後、CD2抗体(カタログ番号:60005-1-Ig、希釈倍率1:3000)を使用し、室温で1.5時間インキュベーションしたWB。(-):未処理細胞ライセート。(+):PNGase F処理細胞ライセート。
|
一般的に使用される3種類のグリコシダーゼ:
- PNGase F—ほとんどすべてのタイプのアスパラギン結合型糖鎖(N結合型糖鎖)を切断します。
- EndoH—高マンノースN結合型糖鎖やある種のハイブリッドタイプのN結合型糖鎖を切断します。
- O-グリコシダーゼ—セリン残基とスレオニン残基からO結合型糖鎖を切断します。
グリコシダーゼを用いた実験では、トラブルシューティングが必要になることがあります。下記のFAQをご覧ください。
|
問題 |
可能性のある原因 |
解決策 |
|
酵素処理しても変化がない。 |
1. 使用酵素とlysis bufferの相性が良くない。 2. 酵素量やインキュベーション時間が不十分。 3. 分離能が低く検出できない。 4. 標的タンパク質は修飾タンパク質ではない。 |
1. 酵素との相性をメーカーに確認します。 2. 酵素量やインキュベーション時間を変えて試験します。 3. 適切な濃度のゲルを使用して、近似バンドを分離します。 4. 他の実験も併せて実施し、修飾の有無を確認します。 |
|
酵素処理後、推定糖鎖付加タンパク質のシグナルがわずかに減衰する。 |
1. 酵素量やインキュベーション時間が不十分。 2. 目的シグナルが2種類のタンパク質で構成されている。または、同一タンパク質が別の修飾を受けている。 |
1. 酵素の使用量を増やす、またはインキュベーション時間を延長します。 2. 他の実験も併せて実施し、その他の型の修飾の有無や、無関係のタンパク質の干渉の有無を確認する。 |
|
酵素処理後のタンパク質の分子量が、計算値と一致しない。 |
1. 酵素量やインキュベーション時間が不十分。 2. タンパク質が他にも修飾を受けている。 |
1. 酵素の使用量を増やす、またはインキュベーション時間を延長します。 2. 他の実験も併せて実施し、その他の型の修飾について検証します。 |


