ゲスト寄稿 | 肝臓がんの分子マーカー
肝細胞がんの分子マーカーについて解説します。
肝細胞がん(HCC:Hepatocellular carcinoma)および胆管がん(CCA:cholangiocarcinoma)に大きく分けられる原発性肝がんは、2000年のがん統計によると、主要ながんの中で患者発生数第5位、死亡原因第3位を占めています(Parkin, 2001)。がん診断のゴールドスタンダードには、画像診断、血清マーカー、ならびに組織分析、肝臓がんマーカーに関する分子学的解析に基づく、がんの特定とサブタイプ分類が挙げられます。
現在、巨大肝腫瘍や疾病末期におけるがんのバイオマーカーが発見されており、例えばc-met阻害剤であるtivantinib(チバンチニブ)の臨床試験が進められています(Santro et al., 2013)。また、チロシンキナーゼの阻害剤であるソラフェニブ(販売名:ネクサバール)は、進行したHCCの治療に使用されています(Llovet et al., 2008)。
1973年から2010年にかけて、HCCの治療転帰に有意な改善が認められたことが報告されました。治療可能な段階でのHCCの早期発見と、肝移植を受ける患者数の増加が、この改善に寄与したことが示唆されます(Njei et al., 2015)。
TorbensonとSchirmacher(2015)は、HCCは病因プロファイルおよび分子プロファイルが不均一であることから、治療に対する反応が変化すると指摘しています。HCCにおける高い再発率と限られた生存率は、治療に対するHCCの高い抵抗性に関連します。現在、60〜70%のHCCは、生検肝臓標本の組織学的検査を実施せず肝臓の画像検査に基づいて診断されています。HCCの早期診断分子マーカーと個別化治療が緊急に必要とされています。
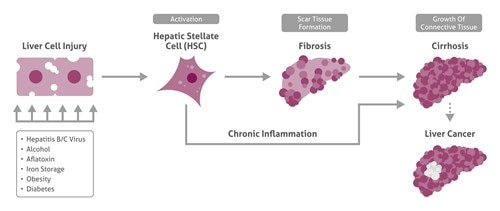
肝損傷と炎症による肝星細胞(HSC:hepatic stellate cells)の活性化の後、線維化が開始し、さらに肝硬変および肝がんへと進行します。
進行後のHCCの主要な分子マーカーが同定されています
HCCに関連する極めて重要な分子バイオマーカーが見つかっています。MDM2とガンキリン(gankyrin)の活性化およびARF、Rb/p16、p27、p53、IGF2Rの不活性化を伴う、細胞周期とアポトーシスチェックポイントの調節解除があります。加えて、Wnt/b catenin、ヘッジホッグ、MET、テロメラーゼ、Myc、PI3K/Akt、βII-spectrinの活性化、およびPrickle 1とPtenの不活性化を伴う、発生経路および発がん経路が関与します(El-Serag and Rudolph, 2007; Kitisin et al., 2007による総説)。マーカーに関する詳細な調査、およびHCCの分類に関する研究が進められています。
HCC発症のリスク因子は明らかです
ここで重要なのは、HCCは損傷を受けた肝臓(正常ではない肝臓)で発症するという点です。約80%の症例で、HCCは肝硬変の後に発症します。HCC発症のリスク因子には、肝炎ウイルス(B、C、D型肝炎ウイルス)の持続感染、ヘモクロマトーシス、肥満、インスリン抵抗性、糖尿病、経口避妊薬、アルコールの摂取、ならびにアフラトキシン、塩化ビニル、その他の肝毒性物質への暴露等があります(El-Serag and Rudolph, 2007)。
HCCにおいてダウンレギュレーション/不活性化されていることが判明した新しい分子マーカー
2015年のHCCに関する調査により、診断と治療の標的となる可能性のある新しい分子が明らかになりました。ダウンレギュレーション(発現抑制)された分子マーカーに対するHCC治療により、各タンパク質の発現レベルが回復する可能性があります。
Degirolamoらは、ファルネソイドX受容体(FXR:farnesoid X receptor)のダウンレギュレーションがHCCに関連していることを発見しました。ファルネソイドX受容体は、胆汁酸の恒常性を保つ転写調節因子であり、肝臓と腸で発現します。著者らは、FXRノックアウトマウスおよびFXR遺伝子導入・再活性化マウスモデルを調査しました。肝臓のFXRを欠損している場合でもFXRを腸で発現させると、FGF15を中心とする作用を介して胆汁酸の恒常性を保ち、HCCの発症を防ぎました。これらの結果は、腸と肝臓との間のクロストークにおけるFXRの役割を浮き彫りにしています。著者らは、体細胞にFXR変異を有する患者に腸選択的なFXRモジュレーター(調節因子)を使用し、HCCを予防することを提案しています。
Koralらは、白血球特異的タンパク質1(LSP1:leukocyte-specific protein 1)の喪失がHCCの発症に関連する可能性を報告しました。標的となるLSP1は、ヒトHCCにおけるコピー数多型解析で発見されました。LSP1は、肝臓では通常、マクロファージや内皮細胞で発現しています。培養肝細胞では、細胞増殖のピーク後の増殖速度低下時にLSP1が発現し、その後LSP1は徐々に増加します。著者らは、in vitroおよびin vivoにおいて、LSP1の発現が増加すると、ラット肝細胞の増殖が減衰することを実証しています。著者らは、早期のHCC診断およびHCC治療の候補ターゲットとしてLSP1を試験することを提案しています。
Zhiらは、βII-spectrin(SPTBN1)をダウンレギュレーションするとHCCの発症が促進される可能性について述べています。βII- spectrinは、細胞分裂とアポトーシスを調節するTGF-βシグナル伝達におけるSmad3/Smad4のアダプタータンパク質です。著者らは、βII-spectrin発現レベルが低下したHCC細胞では、Wntシグナル伝達経路が活性化され、幹細胞様の特徴を獲得することを発見しました。これらの細胞は、既知のWntシグナル伝達阻害剤であるカリスタチン(kallistatin)のレベルが極めて低く、TGF-βおよびWntシグナル伝達の調節不全を示していました。Zhiらは、βII-spectrinとカリスタチンの発現の低下は、無再発生存期間の短縮と関連していることを明らかにしました。
HCCにおいてアップレギュレーション/活性化されていることが判明した新しい分子マーカー
2015年に同定されたマーカーは、その機能の阻害を原理とするHCC治療に採用されるかもしれません。
Suらは、既知のHCC腫瘍マーカーであるガンキリン(gankyrin)の発現が、JNKおよびNF-Y/p300/CBP複合体を介したIL-1β/IRAK-1シグナル伝達によって促進されることを発見しました。ガンキリンのアップレギュレーション(発現上昇)は、IRAK-1阻害剤またはJNK阻害剤それぞれによって阻害されます。この研究では、ガンキリン、肝炎、およびHCCの発症の間に関連性が認められています。著者らは、ガンキリンの阻害がHCC治療のターゲットとなり得ると述べています。
Huntzickerらは、Jag1とNotch2の過剰発現がHCCの発症に関連していることを明らかにしました。研究者らは、HCCおよびCCAのマウスモデルにおいて、Notch1、Notch2、Notch3、jagged1(Jag1)のいずれかを阻害する抗体を使用しました。彼らはJag1およびNotch2のみを阻害することでがんの進行を抑制することを発見しました。つまり、これらのターゲットは治療の選択肢となる可能性があります。
Luらは、C/EBPaのアップレギュレーションがHCCと関連していることを明らかにしました。著者らは、HCC組織マイクロアレイを使用して191名の患者を検査し、C/EBPプローブ陽性の場合は生存率が低いことを発見しました。C/EBPaは、細胞分化やエネルギー代謝に関与するCCAAT/エンハンサー結合タンパク質ファミリーに属する転写因子です。
Ohrnbergerらは、血清応答因子(SRF)がHCCで過剰発現していることを発見しました。SRFは広範に発現する転写因子です。SRFは、Ras/MAPKとRho/アクチンの両方のシグナル伝達によって調節を受けます。著者らは、実験の条件操作に依存して肝細胞で恒常的にSRFを盛んに発現するトランジェニックマウスを作製しました。このマウスの肝臓は、Ctnnb1の活性化変異とIgf2/H19がん胎仔性遺伝子の低メチル化を示し、HCCの発症と相関します。Ohrnbergerらは、HCC治療における戦略として、SRFがアップレギュレーションされているHCCのサブセットに対する、Ras/MAPKおよびRho/アクチンシグナル伝達を同時阻害する方法を提案しています。
Reichlらは、受容体型チロシンキナーゼAxlのアップレギュレーションと活性化がHCCの発症に関与することを明らかにしました。著者らは、間葉系ヘパトーマ細胞株と患者組織を使用し、Axlをノックダウンすると、ヘパトーマ細胞の遊走が減少することを示しました。またAxlの発現は、細胞がTGF-βを介したアポトーシスに対する抵抗性の獲得に寄与することが示唆されました。Axlシグナル伝達は、Smad3リンカー領域のリン酸化を引き起こし、その結果として、PAI1、MMP9、Snailが発現します。さらに、Axlの発現は患者の予後不良と関連していました。これらのデータは、AxlとTGF-βシグナル伝達との間の関連性を示しています。そしてさらに、AxlはHCC療法の有望なターゲットであることが示唆されています。
Srivastavaらは、HCCで過剰発現している星状細胞(アストロサイト)上昇遺伝子-1(AEG-1:astrocyte elevated gene-1)とc-Mycの役割を調査しています。これら2つのがん遺伝子間の連携に関する分子メカニズムを解明するために、著者らはAEG、もしくはc-Myc、またはその両方を発現するトランスジェニックマウスを作製し、どのマウスがどちらの条件(無処置または肝毒性物質による誘発)でHCCの発症や転移が生じるか詳細に調査しました。著者らは、RNAシーケンシング解析を実施し、これらのマウスモデルの肝臓中の遺伝子発現パターンを特定しました。Srivastavaらはこれらのモデルについて、侵襲性HCCのメカニズムの詳細な調査への使用や、治療ターゲットのテストモデルとして使用できるのではないかと提案しています。
結論
HCCは、分子学的不均一性を特徴とし、10〜20年間の慢性的なダメージを受けた損傷肝臓の80%で発症します。個別化医療の戦略、生検HCC組織の発現プロファイリング、バイオマーカーの検証、およびHCCの分類により、HCCの早期診断法、標的療法、および生存率の向上が期待されます。
関連情報へのリンク
Antibodies for liver diseases[PDF]
参考文献
1. El-Serag HB and Rudolph KL. Gastroenterology 2007 Jun;132(7):2557-2576
2. C Degirolamo et al., Hepatology 2015 Jan;61(1):161-170
3. EZ Huntzicker et al., Hepatology 2015 Mar;61(3):942-952
4. B Njei et al., Hepatology 2015 Jan; 61(1): 191-199
5. S Ohrnberger et al., Hepatology 2015 Mar;61(1):979-989
6. K Kitisin et al., Oncogene 2007 Nov 1;26:7103-7110
7. K Koral et al., Hepatology 2015 Feb;61(2):537-547
8. JM Llovet et al., N Engl J Med 2008 Jul 24; 359(4):378-390
9. DG Lu et al., Hepatology 2015 Mar;61(3):965-978
10. DM Parkin, Lancet Oncol 2001 Sep;2(9):533-543
11. P Reichl et al, Hepatology 2015 Mar;61(3):930-941
12. A Santoro et al., Lancet Oncol 2013 Jan;14(1):55-63
13. J Srivastava et al., Hepatology 2015 Mar;61(1):915-929
14. B Su et al., Hepatology 2015 Feb;61(2):585-597
15. X Zhi et al., Hepatology 2015 Feb;61(2):598-612
16. M Torbenson and P Schirmacher. Hepatology 2015 Feb;61(2):431-433
著者について
Iryna Ilkavets氏は、ベラルーシ国立大学で生化学を学び、ミュンヘン大学で分子生物学の博士号を取得しました。ベラルーシ科学アカデミー(NASB)・光生物学研究所(ミンスク、ベラルーシ)で研究に従事し、その後、ドイツのミュンヘン大学、ハイデルベルク大学、ハイデルベルク理論研究所で研究に従事しました。2007年以来、彼女は肝臓病理の研究に携わっています。


