ミトコンドリア呼吸鎖スーパー複合体:COX7Aアイソフォームの役割
COX7Aアイソフォームは細胞のエネルギー産生機構を代謝需要に応じて調節します。
Michele Brischigliaro博士著(マイアミ大学ミラー医学部、博士研究員)
*Brischigliaro博士は、ミトコンドリア研究の第一人者であるErika Fernandez-Vizarra博士に師事していました。Erika Fernandez-Vizarra博士は、プロテインテックの抗体を使用して、解糖系優位への切替えに伴うOXPHOSの編成と機能の適応変化に関する研究を発表しています。
|
目次 OXPHOS(酸化的リン酸化)の機能とは? |
OXPHOS(酸化的リン酸化)の機能とは?
あらゆる生物は、生命を維持するためにエネルギー変換を行います。ミトコンドリアは、好気性真核細胞においてエネルギーの大半をアデノシン三リン酸(ATP:Adenosine triphosphate)の形で供給する細胞小器官です。
ミトコンドリアという名称は、1898年にドイツの微生物学者カール・ベンダ(Carl Benda)が提唱した造語です。ベンダはこの細胞小器官を、ときに糸状の構造をとる粒状の構造体であると表現し、ミトコンドリア(mitochondrion)という用語は、「糸」を意味するmitosと「粒」を意味するchondrionという2つのギリシャ語を組み合わせて作られました。ミトコンドリアの起源については様々な説が存在しますが、いわゆる「細胞内共生説」を支持するエビデンスが有力かつ広く受け入れられています。細胞内共生説では、ミトコンドリアは、好気呼吸を行うアルファプロバクテリア綱の細菌がアスガルド古細菌の近縁種である嫌気性宿主細胞内に安定的に内部共生して生じた祖先細胞小器官に由来するとされます1,2。真核細胞の場合、栄養素から得られるエネルギーは代謝経路を介して代謝産物に変換され、ミトコンドリアはその代謝産物を利用してATPを産生します。生じたATPは細胞内の多くの生化学反応に必要なエネルギーの「通貨」となります。
エネルギー変換を担う分子機構は酸化的リン酸化(OXPHOS:oxidative phosphorylation)システムです。このシステムはミトコンドリア内膜に埋め込まれた5種類の多タンパク質複合体で構成されています。酸化的リン酸化は、電子伝達系とATP合成という2種類の厳密に制御されたプロセスからなります。電子伝達系は、呼吸鎖複合体I~IVと複合体間を移動する2種類の電子伝達体(補酵素Q、シトクロムc)との間に生じる一連の酸化還元反応に基づくプロセスです。呼吸鎖複合体IとIIは、それぞれNADHとFADH2から電子を受け取ります。呼吸鎖複合体I、III、IVによる電子伝達の過程では電子の移動がプロトンポンプと連動し、プロトンがミトコンドリアマトリックスからミトコンドリア膜間腔へ汲み出されます。プロトンポンプは、呼吸鎖複合体V(ATP合成酵素)がATPを合成するためのプロトン駆動力を供給する電気化学的勾配を生み出します。
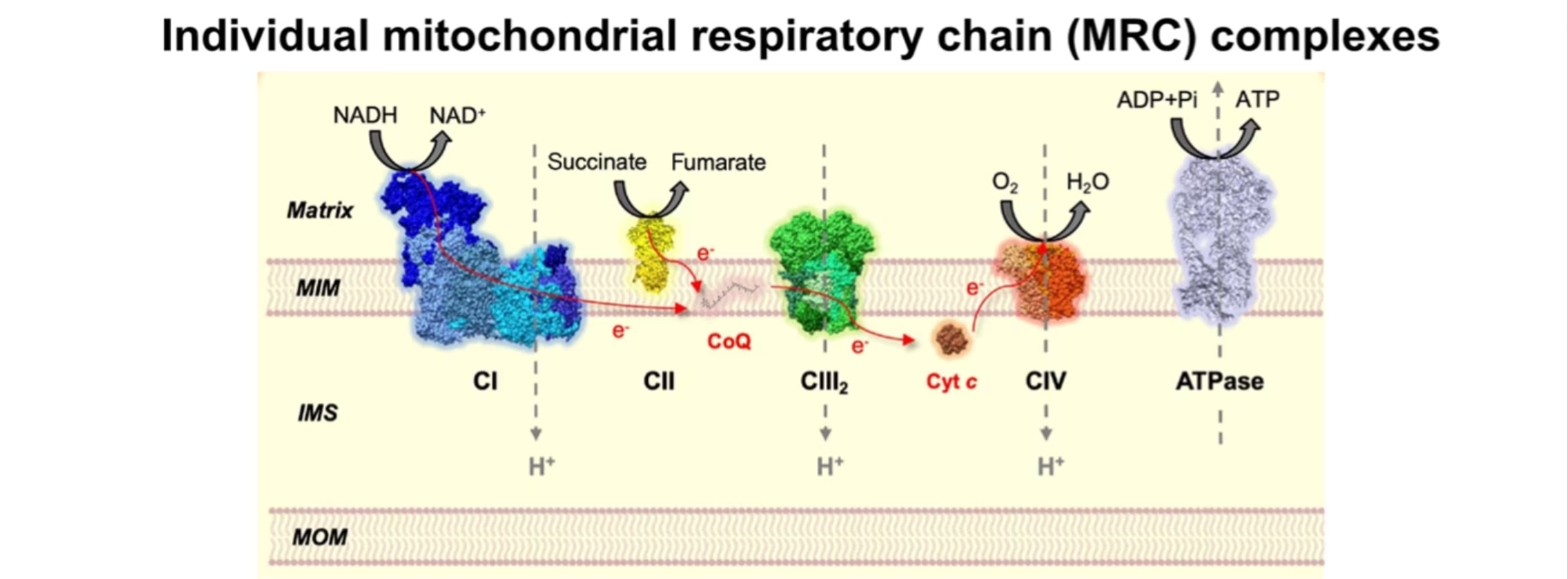
図1. ミトコンドリア呼吸鎖(MRC)複合体およびATP合成酵素が酸化的リン酸化(OXPHOS)システムを構成しています(E Fernández-Vizarra, C Ugalde. Trends in Biochemical Sciences. 202216を一部改変)。
MOM:ミトコンドリア外膜、IMS:ミトコンドリア膜間腔、MIM:ミトコンドリア内膜
ここで重要となるのは、NADHとFADH2の形でミトコンドリア呼吸鎖(MRC:Mitochondrial respiratory chain)に電子を供給する還元当量の多くが、様々な代謝経路が集束する中心的な経路であるクレブス回路、別名クエン酸回路(TCA回路)を介して産生されるという点です。そのため、酸化的リン酸化とTCA回路は密接に連携しており、この2種類の経路が相互に影響し協調するように働く精緻な制御機構が存在すると考えられます(図2)。TCA回路に基質を供給する中心的な代謝経路の1つが、グルコースが解糖系で分解されて生じたピルビン酸を別の代謝産物へと変換する過程です。ここで重要なのは、TCA回路へのピルビン酸の移行を制御する律速酵素がピルビン酸デヒドロゲナーゼ複合体(PDH:Pyruvate dehydrogenase complex)であるという点です。ピルビン酸デヒドロゲナーゼ複合体は、ピルビン酸を脱炭酸してアセチルCoAに変換する反応を触媒する酵素です(図2)。ピルビン酸がTCA回路に取り込まれるかどうかが、ピルビン酸が酸化的代謝へ進むのか、嫌気的発酵により乳酸へ変換される経路へ進むのかという代謝の分岐を決定します。
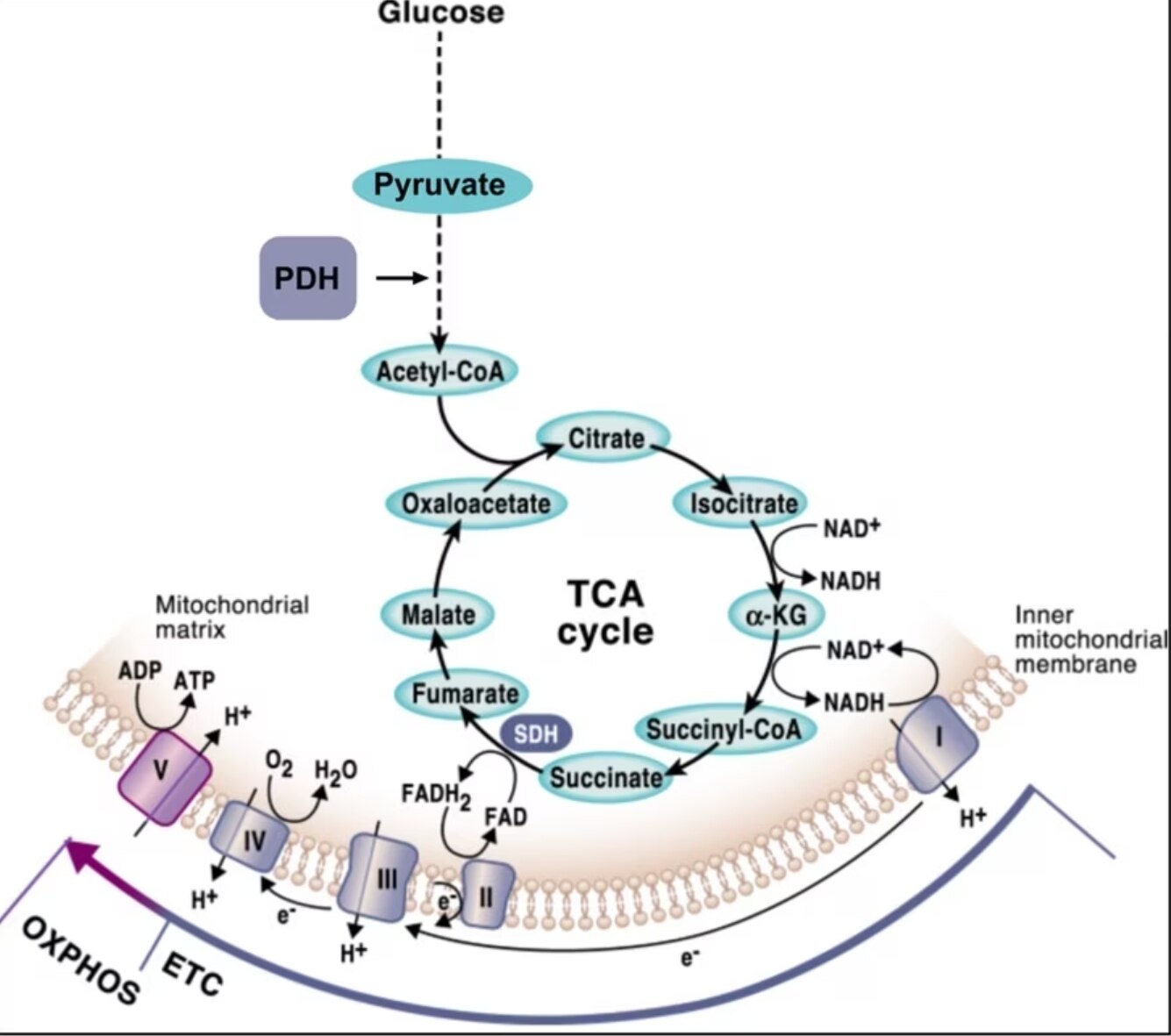
図2. 酸化的リン酸化とTCA回路との相互接続(I M-Reyes, N S Chandel. Nature Communications. 202018より引用)。
ミトコンドリア呼吸鎖機構:呼吸鎖スーパー複合体
酸化的リン酸化に関与するタンパク質複合体は互いに独立した複合体として存在していますが、会合して「スーパー複合体」と呼ばれるさまざまな組み合わせの超分子構造を形成する場合があります。このようなスーパー複合体については20年以上前に報告されており3、近年はスーパー複合体の構造が解明され複数の論文で詳述されています4。分子量やサブユニットの構成に基づき求められた化学量論から、スーパー複合体は主にIII2+IV1、I1+III2、I1+III2+IV1の形で存在すると考えられ、そのうちの1つのI1+III2+IV1は「レスピラソーム(Respirasome)」として知られています(図3)。3種類の形態を示すスーパー複合体に加え、複合体IVと複合体Vは二量体の状態で存在します。
スーパー複合体形成に重要な要因の1つは、複合体IVの構造サブユニットであるCOX7Aの複数のアイソフォームです。COX7AにはCOX7A1とCOX7A2が存在し、細胞の種類に依存して組織特異的に異なる発現パターンを示します。COX7A1は主に筋組織に発現する一方で、COX7A2は普遍的に発現します5。哺乳類には、COX7A2LあるいはCOX7RPという第3のアイソフォームが存在します。この第3のアイソフォームは、主にスーパー複合体に結合しており、今では「SCAF1(Supercomplex-associated factor 1 / Supercomplex assembly factor 1)」という名称で知られています6。SCAF1はCOX7Aの中でも全長が長いアイソフォームであり、当初は複合体IVが呼吸鎖スーパー複合体のIII2+IV1やレスピラソームと結合するために必須のアイソフォームである7と考えられていました。近年の哺乳類スーパー複合体III2+IV1の構造解析により、スーパー複合体III2+IV1形成時のSCAF1の役割が解明され、CIII2構造内にIV1をつなぎとめる領域が明らかになり8、両者の間に強力な相互作用を生じさせることが判明しました。しかし、COX7A1/2を構成因子とするレスピラソームの方が多く存在することから9、レスピラソーム生合成時におけるSCAF1の機能的役割は複合体形成において中心的な役割を担っているわけではないと考えられます。SCAF1が存在しなくともMRCのエネルギー産生機能全体に深刻な影響を及ぼすことはないものの10,11、特定の代謝変化と関連がある12,13,14点は特に注目すべきであるといえます。
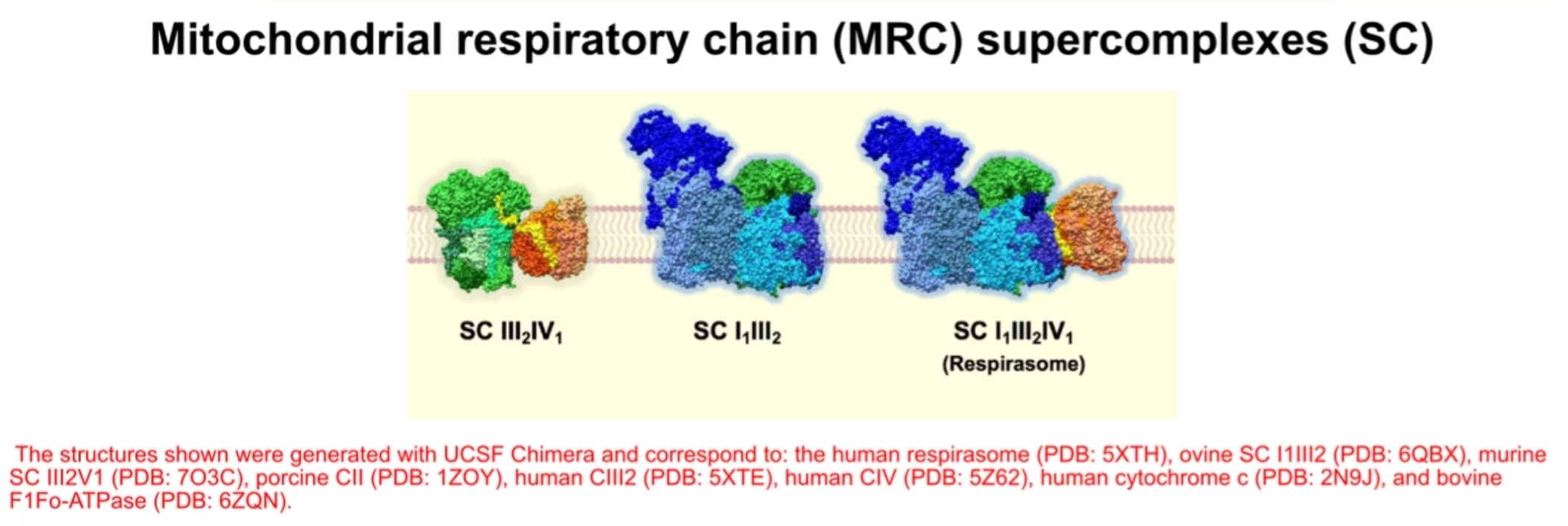
図3. ミトコンドリア呼吸鎖(MRC)のスーパー複合体(SC)としての配置・構成(E Fernández-Vizarra, C Ugalde. Trends in Biochemical Sciences. 202216を改変)。
推定されるスーパー複合体の機能
様々なスーパー複合体の種類や構造解析、スーパー複合体を構成するサブユニット同士の構造的な結合関係や相互作用は現在広く解明されていますが、この研究領域において、スーパー複合体の存在に関する機能的意義は依然として活発に議論されており15,16、スーパー複合体に関する多くの仮説が提唱され、現在も検証が進んでいます。
第1の可能性は、スーパー複合体は「基質チャネリング」に必要不可欠であるという考え方です。具体的には、スーパー複合体を形成することで補酵素Qとシトクロムcが局所的閉鎖プールを形成し、電子伝達効率が高まるのではないかという見方です。しかし、スーパー複合体が基質チャネリングに不可欠であるという仮説は、スーパー複合体の速度論や構造に関するデータとは整合しません。実際に、現在公開されているレスピラソームの構造は基質チャネリングが発生するには酵素の活性部位間の距離が遠すぎることを示しています8,17。スーパー複合体の存在意義を説明づける第2の可能性は、スーパー複合体が複合体構造の安定化および/または個々の複合体の効率的構築のプラットフォームとして役立つという構造的機能を担っているのではないかという仮説です。最も新しい第3の仮説は、スーパー複合体がミトコンドリア呼吸鎖の会合・編成に関与し、代謝状態に応じた酸化的リン酸化効率の調節を可能にするという仮説です。
ミトコンドリア呼吸鎖(MRC)の代謝制御
SCAF1およびCOX7A1/2は組織・細胞や条件によってスーパー複合体に組み込まれる優勢なアイソフォームが異なるため、様々な形態の複合体IVが分布します。
HEK293T細胞の場合、主要なアイソフォームはCOX7A2であり、COX7A2アイソフォームをノックアウトした場合、SCAF1が高レベルに認められるようになります6。SCAF1が増加すると、SCAF1が会合した複合体IVが形成するスーパー複合体III2+IV1やS-レスピラソーム(SC I+III2+IVSCAF1)を構成要素とするS-MRCというMRCの再構成が優勢になります。ここで重要なのは、S-MRC再構成により酸化的リン酸化の効率が低下するという点です。反対にSCAF1をノックアウトすると、COX7A2が複合体IVに会合してC-レスピラソームとなる特異的C-MRCが形成され、スーパー複合体III2+IV1は形成されません。生理的条件下ではS-MRCとC-MRCは共に存在し、C-MRCが主に構成されます。実際に、SCAF1が消失してもミトコンドリア呼吸鎖の機能的欠陥を引き起こすことはありませんでした。ここで重要なのは、様々な代謝条件に応答してC-MRCとS-MRCが調節を受けるという点です。ピルビン酸デヒドロゲナーゼ複合体(PDH)の作用によりTCA回路に必要な物質が十分に供給されている代謝条件下では、C-レスピラソームと複合体IVが優先的に存在するようになります。したがって、HEK293T細胞系でCOX7A2をノックアウトすると(この場合、SCAF1だけが発現するようになります)、細胞はPDHの持続的活性化によって誘導される酸化的リン酸化要求の高い代謝環境に適応することができません。反対に、PDHの遺伝子変異疾患の患者の細胞のようなPDHの活性が低下した状態では、代謝は解糖にシフトしSCAF1レベルが上昇することでS-MRCが優先的に形成されるようになります。結論として、COX7A2とSCAF1のような異なるCOX7Aアイソフォームの発現は、異なる代謝要求下でミトコンドリア呼吸鎖を精密に制御するために極めて重要なパラメーターとなります(図4)。
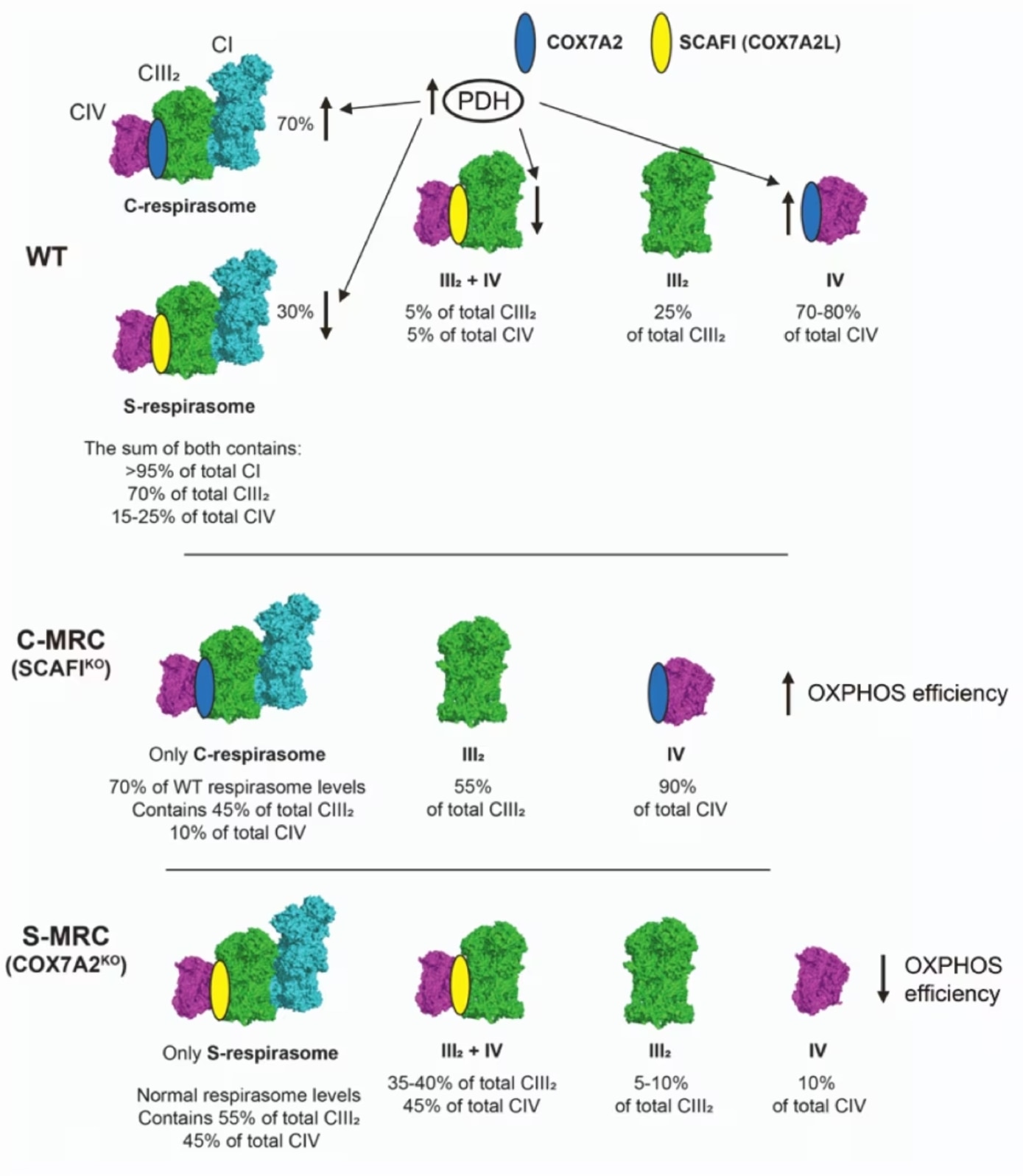
図4. COX7Aアイソフォームは代謝の切替えに合わせてミトコンドリア呼吸鎖を適応させます(F-Vizarra, et al. Cell Metabolism. 20226を改変)。
プロテインテックのミトコンドリア研究用製品
OXPHOS
|
マーカー名 |
複合体 |
|
I |
|
|
II |
|
|
II |
|
|
IV |
|
|
V |
汎用的なミトコンドリアマーカー関連製品
COX7Aアイソフォーム関連製品
参考文献
- M W Gray. Mosaic nature of the mitochondrial proteome: Implications for the origin and evolution of mitochondria. Proc Natl Acad Sci U S A. 2015 Aug 18;112(33):10133-8.
- K Z-Niedzwiedzka, et al. Asgard archaea illuminate the origin of eukaryotic cellular complexity. Nature. 2017 Jan 19;541(7637):353-358.
- H Schägger, K Pfeiffer. Supercomplexes in the respiratory chains of yeast and mammalian mitochondria. EMBO J. 2000 Apr 17;19(8):1777-83.
- N J Caruana, D A Stroud. The road to the structure of the mitochondrial respiratory chain supercomplex. Biochem Soc Trans. 2020 Apr 29;48(2):621-629.
- C A Sinkler, et al. Tissue- and Condition-Specific Isoforms of Mammalian Cytochrome c Oxidase Subunits: From Function to Human Disease. Oxid Med Cell Longev. 2017:2017:1534056.
- E F-Vizarra, M Zeviani, M T Ryan, C Ugalde, et al. Two independent respiratory chains adapt OXPHOS performance to glycolytic switch. Cell Metab. 2022 Nov 1;34(11):1792-1808.e6.
- E L-Brun, R M-Loshuertos, et al. Supercomplex assembly determines electron flux in the mitochondrial electron transport chain. Science. 2013 Jun 28;340(6140):1567-70.
- I Vercellino, L A Sazanov. Structure and assembly of the mammalian mitochondrial supercomplex CIII2CIV. Nature. 2021 Oct;598(7880):364-367.
- E F-Vizarra, C Ugalde, et al. SILAC-based complexome profiling dissects the structural organization of the human respiratory supercomplexes in SCAFIKO cells. Biochim Biophys Acta Bioenerg. 2021 Jul 1;1862(7):148414.
- A Mourier, et al. The respiratory chain supercomplex organization is independent of COX7a2l isoforms. Cell Metab. 2014 Dec 2;20(6):1069-75.
- T L-Jarne, E Nývltová, et al. Human COX7A2L Regulates Complex III Biogenesis and Promotes Supercomplex Organization Remodeling without Affecting Mitochondrial Bioenergetics. Cell Rep. 2018 Nov 13;25(7):1786-1799.e4.
- E Calvo, S Cogliati, P H-Agustín, M L-López, et al. Functional role of respiratory supercomplexes in mice: SCAF1 relevance and segmentation of the Qpool. Sci Adv. 2020 Jun 24;6(26):eaba7509.
- C G-Poyatos, et al. Scaf1 promotes respiratory supercomplexes and metabolic efficiency in zebrafish. EMBO Rep. 2020 Jul 3;21(7):e50287.
- J Berndtsson, A Kohler, et al. Respiratory supercomplexes enhance electron transport by decreasing cytochrome c diffusion distance. EMBO Rep. 2020 Dec 3;21(12):e51015.
- T L-Jarne, C Ugalde. Respiratory chain supercomplexes: Structures, function and biogenesis. Semin Cell Dev Biol. 2018 Apr:76:179-190.
- E F-Vizarra, C Ugalde. Cooperative assembly of the mitochondrial respiratory chain. Trends Biochem Sci. 2022 Dec;47(12):999-1008.
- J Hirst. Open questions: respiratory chain supercomplexes-why are they there and what do they do? BMC Biol. 2018 Nov 1;16(1):111.
- I M-Reyes, N S Chandel. Mitochondrial TCA cycle metabolites control physiology and disease. Nat Commun. 2020 Jan 3;11(1):102.


