ゲスト寄稿 | ミトコンドリアは単なる細胞のエネルギー発電所ではありません
ミトコンドリアは、細胞のエネルギー発電所として機能することで知られていますが、現在では様々な疾患との関わりも明らかになっています。
Sophie Quick著
10億年以上前に原始的な細菌と初期の真核細胞が融合した結果、ミトコンドリアが誕生し、種を定義する内部共生をもたらしたと考えられています。こうした内部共生型の細胞小器官は、ATP‐プロトンポンプを介して細胞の化学エネルギーを生成するだけでなく、シグナル伝達、分化、アポトーシス等の多くの細胞プロセスで重要な役割を果たしています。ヒト細胞には数十から数千のミトコンドリアが認められ、絶えず融合と分裂を繰り返す非常に動的なネットワークを構成しています。
ミトコンドリアDNA(mtDNA)に遺伝性変異または自然発生的な突然変異が生じると、ミトコンドリア病と呼ばれる特定の疾患サブセットを発症します。さらに、ミトコンドリアは多くの一般的なヒト疾患と関係があるとされています。細胞プロセスやミトコンドリア動態に影響を及ぼす重要なエフェクタータンパク質の変性は、例を挙げると、神経変性、心血管疾患、がん等で特定されています。本稿では、2015年から2016年の18ヶ月間にかけて発表された、特定のミトコンドリアタンパク質が病理学において果たす役割や、そのような疾患を治療するための治療例等を示した研究をご紹介します。
パーキンソン病におけるミトコンドリア
長い間、ミトコンドリアは脳の黒質中のドーパミン産生細胞に影響を及ぼす変性疾患であるパーキンソン病(PD:Parkinson’s disease)と関連があるとされています。これらのドーパミン作動性ニューロンは、ミトコンドリアの機能喪失に関与するプロセスや、主にα‐シヌクレインからなるタンパク質性凝集体の蓄積を介して漸進的に死滅します。このプロセスは完全には解明されていませんが、現在のところ対症療法しか存在せず治療することができない特徴的な運動障害の症状を発症します。
損傷タンパク質やミトコンドリアの分解に関与するE3リガーゼであるパーキン(parkin)の突然変異は、約20年前にPDの原因遺伝子の1つとして初めて特定されました。この遺伝子の突然変異によりパーキンの基質が蓄積し、この変異はまれな家族性疾患と歴史的に関連付けられてきました。しかし、近年の研究(Andersen et al, 2016)では、酸化ストレスがパーキンに同じように影響を及ぼすことが示されています。酸化ストレスは孤発性PDの主な要因の1つであるため、現在パーキンが関与する症例はPD症例の95%にまで及んでいます。また、PDモデルマウスを使用して、研究者らはパーキンの機能不全に関与するシグナル伝達経路を研究し、PGC-1αとTFEBを含む創薬ターゲットになり得る重要なタンパク質を発見しました。TFEBは、ミトコンドリアの分解に関与し、一方PGC-1αは、ミトコンドリアの合成に関与しており、両者とも酸化ストレスでダウンレギュレーション(発現低下)されることが判明しました。興味深いことに、PDマウスモデルでPGC-1αの発現が増加すると、ミトコンドリア機能が回復し、ニューロンの細胞死を防ぎました。この結果は、こうしたタンパク質が疾患の予防治療のターゲットとなる可能性があることを示しています。
2016年6月に発表された研究(Di Maio et al, 2016)は、病態形成時の2つの特徴であるα‐シヌクレインの蓄積とミトコンドリアの機能障害が、特有のミトコンドリア受容体タンパク質TOM20(Translocase of the Outer Machinery 20)を介してどのように関連しているかを明らかにしています。TOM20は、ミトコンドリアのタンパク質インポート機構のサブユニットタンパク質として外膜上に存在します。この研究では、PDのげっ歯類モデルにおいて、何種類かの形状のα‐シヌクレインがTOM20に強い親和性で結合することで、共受容体TOM22とTOM20の相互作用を妨げ、ミトコンドリアのエネルギー生成機能に影響を及ぼすことが示されました。PD患者の脳組織において、タンパク質輸送機構が妨げられることによるミトコンドリアの活動低下と、蓄積したα‐シヌクレインにより生じる毒性が共に確認され、さらに研究チームは培養細胞において、α‐シヌクレインとTOM20の結合を阻害するとミトコンドリアの損傷を十分に防止できることを示しました。今後、α‐シヌクレインを改変するとin vivoにおける疾患症状を改善できるのか否かを確認する研究を行う必要がありますが、TOM20を介するα‐シヌクレインのミトコンドリアにおける共局在は、PD研究における興味深い研究テーマを提供しています。
関連製品
| TOM20 | TOM22 |
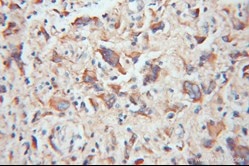 |
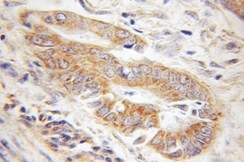 |
| TOM20抗体(カタログ番号:11802-1-AP、希釈倍率1:100)を使用したパラフィン包埋ヒト神経膠腫のIHC(免疫組織化学)(10倍レンズを使用) | TOM22抗体(カタログ番号:11278-1-AP、希釈倍率1:100)を使用したパラフィン包埋ヒト結腸癌のIHC(10倍レンズを使用) |
がんにおけるミトコンドリア
がんの腫瘍細胞が無秩序に細胞分裂する際、ワールブルグ効果(Warburg effect)として知られるミトコンドリアによる酸化的リン酸化から解糖系への細胞のエネルギー産生機構の切り換えが生じます。ミトコンドリア機能障害ががんの根本原因であるという当初の理論は、発がん遺伝子の変異が解明されることにより置き換わっていますが、ミトコンドリアは依然として腫瘍の発達における重要な役割を担い、アポトーシスシグナル伝達経路や酸化還元調節経路等の経路に影響を及ぼしていることは明らかです。2015年、がん細胞が実際にミトコンドリアを乗っ取って同化呼吸の増大を補助し腫瘍の成長を促進する仕組みを示した、がんの悪化に関する重要な見解が研究グループによって発表されました(Kashatus et al, 2015)。Ras遺伝子の変異はすべてのがんで多く認められますが、これは培養細胞やげっ歯類モデルの両者において、異常なほど速い速度でミトコンドリアを分裂させる原因となります。さらに、研究者らはミトコンドリアの複製に関与する酵素をノックダウンすることで、腫瘍の増殖を阻止することに成功しました。
また、ミトコンドリア媒介性アポトーシスもがん細胞の潜在的な治療法として注目されています。特定のミトコンドリアタンパク質と結合するとタンパク質を活性化させる抗体を使用することで、ミトコンドリア膜の透過性が亢進し、有害なカスパーゼ経路を活性化させるチトクローム等のタンパク質が漏出し、細胞死を開始させることが可能であると研究者らは提唱しています。実際に2016年の5月に研究者らがアポトーシスのトリガーとなるBakを直接的に活性化する方法をNature誌に発表しています(Iyer et al, 2016)。彼らは、活性部位の三次元構造の特定に成功しており、それによって新しい標的部位を持つ薬剤の設計と開発に資する情報が得られる可能性があります。
心血管疾患におけるミトコンドリア
世界の死因の第1位を占める冠動脈性心疾患(CHD:Coronary heart disease)は、心筋細胞に供給される酸素が不足することで発症するとされています。低酸素症はATP産生を抑制し、細胞ストレスとミトコンドリアによる活性酸素種(ROS:reactive oxygen species)の過剰産生を引き起こします。ROSの蓄積は心臓細胞のアポトーシスやネクローシスにつながるため、研究者らによりROSの蓄積は疾患の病因と密接な関係があると考えられています。
欠陥のあるミトコンドリア呼吸鎖複合体は、この疾患進行のメカニズムにおいて重要な役割を果たす因子です。正常なミトコンドリアが低酸素に反応してATP産生能力を増強し、ATP産生における最大呼吸容量(maximum respiratory capacity)と基礎呼吸容量(basal respiratory capacity)の差分を利用する能力は、CHDで損傷を受ける可能性のある因子によって調節を受けるのではないかと提唱されています。2015年、研究チーム(Pflenger et al, 2015)は、呼吸鎖複合体IIのSdhが低酸素状態後の細胞の生存を制御する代謝センサーであるというエビデンスを報告しました。このタンパク質を研究対象とすることで、この疾患の進行に関する新しい情報が得られる可能性があります。
ミトコンドリアの膜構造を動的に変化させる性質も、疾患の進行に重要な役割を果たします。ミトコンドリアの分裂と融合のネットワークは、ミトコンドリア融合タンパク質Mfn1(ミトフシン1)やMfn2(ミトフシン2)等の多くのタンパク質によって制御されています。これらのタンパク質を過剰発現させると、細胞が低酸素状態になった後に生じるROSの産生増加から細胞を保護すると考えられます。2015年、マックスプランク研究所のチーム(Mourier et al, 2015)は、Mfn2を欠損させた心臓細胞は代謝障害を示すことを明らかにしました。これは、呼吸鎖経路のさらに下流で生合成される補酵素を細胞に補充することで部分的に機能が回復するため、Mfn2の突然変異を有する患者の治療選択肢となり得ることを示しています。
ミトコンドリアは、多くのメカニズムを介したROSの生成を通じて、心臓疾患の進行に影響を及ぼします。研究が進むに従って、ミトコンドリアは、心臓保護に関する興味深い研究対象になりつつあります。
| MFN1 |
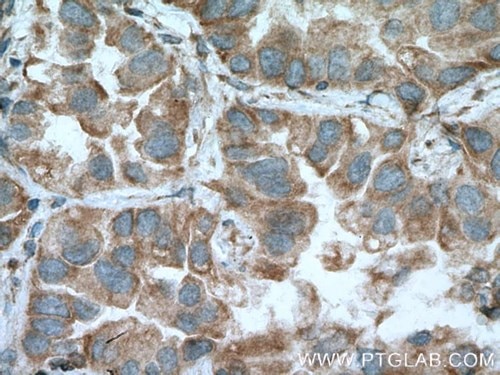 |
| MFN1抗体(カタログ番号:13798-1-AP、希釈倍率1:200)を使用したパラフィン包埋ヒト肺癌組織スライドのIHC(40倍レンズを使用)。 |
今後の展望
本稿で言及されているタンパク質の多くは、融合、分裂、マイトファジー等のミトコンドリアのダイナミクスに対する各タンパク質の影響に基づいて、様々な疾患との関連が認められているため、幅広い研究分野に興味深い研究テーマを提供します。フィラデルフィア小児病院(Children’s Hospital of Philadelphia)のミトコンドリア研究者が先駆けて提唱したある説は、症状をきたす臓器に着目した疾患の治療は生体エネルギー論を完全に見落としているというものです(Picard et al, 2015)。この説は、mtDNAにコードされた必須のエネルギー産生遺伝子と核DNA間の相互作用は、正常時や疾患発症時により重要な役割を果たすという考え方を提唱しています。現在は疾患を治療する際に臓器を対象とする手法が支持されていますが、ミトコンドリアを対象とした手法は新たな研究や治療法の開発を活発化させる一助となるかもしれません。一方、急速に進歩している領域に胚のミトコンドリア補充療法という治療法が存在し、これはミトコンドリア病を有する母親由来の欠陥のあるmtDNAを正常なmtDNAと置き換えるもので、真の個別化医療の道を拓く可能性があります。受け継いだ遺伝形質の改変には身体的・倫理的問題が含まれているため、この新たな研究分野では、研究者らは数多くの問題を検討する必要があります(Falk, Marni J. et al, 2016)。発生のすべての段階におけるミトコンドリアの役割を解明することで、様々な疾患のモデル化や、治療法の開発等の能力が進歩します。
参考文献
1. Andersen, Julie et al. Detrimental effects of oxidative losses in parkin activity in a model of sporadic Parkinson’s disease are attenuated by restoration of PGC1 alpha. Neurobiology of Disease, June 2016
2. Di Maio, Roberto et al. α-Synuclein binds to TOM20 and inhibits mitochondrial protein import in Parkinson’s disease, Science Translational Medicine 08 Jun 2016: Vol. 8, Issue 342, pp. 342ra78
3. Kashatus, Jennifer et al. Erk2 Phosphorylation of Drp1 Promotes Mitochondrial Fission and MAPK-Driven Tumor Growth. Molecular Cell, Volume 57, Issue 3
4. Iyer, Sweta et al. Identification of an activation site in Bak and mitochondrial Bax triggered by antibodies. Nature Communications, 2016; 7: 11734
5. Pfleger, J et al, Mitochondrial complex II is a source of the reserve respiratory capacity that is regulated by metabolic sensors and promotes cell survival, Cell Death and Disease (2015) 6, e1835;
6. Mourier, A. et al, Mitofusin 2 is required to maintain mitochondrial coenzyme Q levels. The Journal of Cell Biology, 2015; 208 (4): 429
7. Picard, M. et al. Mitochondrial functions modulate neuroendocrine, metabolic, inflammatory, and transcriptional responses to acute psychological stress. Proceedings of the National Academy of Sciences, 2015
8. Falk, Marni J. et al. Mitochondrial Replacement Techniques — Implications for the Clinical Community. New England Journal of Medicine, 2016

