失われた塩基対:DNA損傷
様々な環境因子や内在性因子が原因となってDNA損傷が生じ、細胞変性、老化、腫瘍形成等を引き起こします。
DNAについて
DNAは、細胞の最も中心的な構成要素です。ヒトゲノムは、約2万個のタンパク質と多種多様な種類のRNAをコードしており、これらは個々の単一細胞の正常な構造と働きに関する重要な役割を担います。
DNAは、RNAとタンパク質の設計図であるために、DNAの完全性は非常に重要です。細胞は、DNA損傷の原因となる多くの内在性因子や環境因子に日頃から曝されており、結果としてDNA構造異常、つまりタンパク質の機能不全や正常に機能しないタンパク質が生じます。
DNA損傷が修復されない場合、早期老化、変性疾患、腫瘍形成に至る可能性があります。ほとんどのDNA損傷修復は、複製中または複製後すぐに起こるため、非増殖細胞(例:筋細胞、ニューロン)はDNA損傷を蓄積するリスクが高くなります。これは、アテローム性動脈硬化症1や、例えばアルツハイマー病2といった神経変性疾患に反映される可能性があります。平均寿命の延長と現代の環境問題により、DNA損傷や加齢に伴う疾患が増加しています。DNAは、内在性および外因性の様々な要因に絶え間なく曝され、損傷を受けています。したがって、最も一般的なDNA損傷メカニズムを明らかにし、理解することが重要となります(図1)。
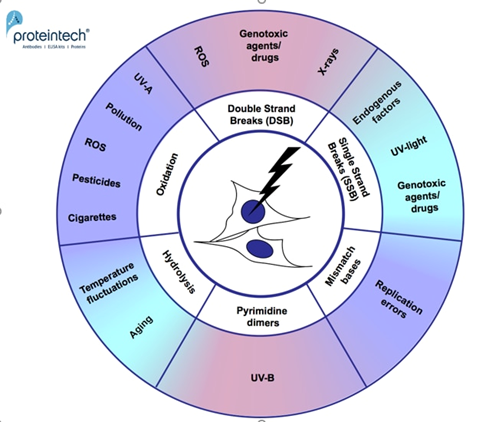
図1. DNA損傷メカニズム。
DNA損傷:原因と影響
DNAの損傷に関して、私たちがまず思いつくのは、紫外線曝露、熱ストレス、毒物、殺虫剤等の環境要因です。しかし、DNA損傷は薬物療法によって起こることもあります。化学療法薬(例:ブレオマイシン)は、増殖速度の速い腫瘍細胞を攻撃し、DNA鎖切断した後に細胞死を誘導します。ウイルス感染(例:アデノウイルス、ヒトパピローマウイルス、ヘルペスウイルス3)もDNA損傷を誘導します。感染中、ウイルスは直接的にDNA鎖切断をするだけでなく、修復タンパク質を阻害、または分解していると考えられます。
しかし、細胞プロセス時の副次的産物が原因となり、細胞は頻繁にDNA損傷を受けていることが推定されています4。例えば、ROS(reactive oxygen species:活性酸素種)は、ミトコンドリアでのエネルギー産生時に生成します。通常、ROSは、スーパーオキシドジスムターゼ、カタラーゼ、ペルオキシダーゼ等の酵素によって、より活性の低い酸素種に変換されます。解毒機構が適切に働かなくなると、ROSは酸化ストレスや細胞損傷の原因となります。
DNA損傷のもう1つの内在性要因となるのがDNA複製です。DNA複製によって新たに合成されたDNA鎖中に不正確な塩基の挿入が生じます。エラーが修復されなければ、これが次の複製サイクル時に両方のDNA鎖に取り込まれ、突然変異が生じます。
DNA損傷は、DNA構造に物理的な異常が生じることとも定義されており、その根底にある分子メカニズムに基づいて、7つのタイプに分類することができます(図2)。
DNA損傷の種類
1. 酸化:
酸化ストレスは、酸化的リン酸化中の細胞内プロセス、および外部要因(例:UV-A、喫煙、汚染、殺虫剤5,6)の両方に起因します。活性酸素種(ROS)には、ヒドロキシルラジカル、スーパーオキシドラジカル、過酸化水素、酸素等があり、いずれもDNAを酸化する作用があります。最も一般的な酸化生成物は8-オキソグアニン(8-oxo guanine)であり、G-TまたはG-A塩基転換が生じます(図2;1)。
2. 加水分解:
A. 脱アミノ化
DNAの脱アミノ化損傷は、時間の経過とともに自然に蓄積されると考えられています。これは、その老化プロセスを原因とするがん化に関与していることが示されています。シトシンは、加水分解を受けてアミノ基を失い、その結果ウラシルに変化します。ウラシル-アデニンにより、点突然変異が生じます(図2;2A)。
B. 脱プリン化
脱プリン化は、自然に起こりますが、熱変動のためにより高い頻度で発生します。通常、アデニンまたはグアニンが加水分解によりデオキシ糖骨格から除去され、DNA傷害が生じます(図2;2B)。
3. ピリミジン二量体:
ピリミジン二量体は、主にUV-B波によって引き起こされ、メラノーマの原因となる可能性が示唆されています。隣接する2つのピリミジンが共有結合し、塩基対形成プロセスに干渉します。最も一般的な生成産物は、シクロブタン型ピリミジン二量体(CPDs)、6-4型光産物(6-4PPs:ピリミジン-(6-4)-ピリミドン/ピリミジン-(6-4)-ピリミジノン)等です(図2;3)。
4. ミスマッチ塩基:
ミスマッチ塩基は、誤った塩基がDNA鎖の1本に組み込まれたときに生じる複製エラーによって形成されます。次の複製サイクルの際、この鎖はDNA合成のテンプレートとなり新しい塩基対を形成します。その結果、「点」突然変異が起こり、DNA配列が変化します(図2;4)。
5. 一本鎖切断(SSB:single strand breaks):
DNAの一本鎖切断(SSB)は、最も頻繁に生じる内在性DNA損傷の原因です。SSBは、UVへの暴露、遺伝毒性物質(例:ブレオマイシン)への暴露によっても生じます(図2;5)。
6. 二本鎖切断(DSB:double strand breaks):
二本鎖切断(DSB)は、自然に発生し、減数分裂組換えや自然抗体の多様性に必須です。ROS、電離放射線照射、遺伝毒性物質、あるいは複製時の未修復SSB等が生じた場合に切断DNAは異常を呈します。たとえ修復されたとしても、DNA異常によってゲノムの突然変異や欠失が生じます。ヒストンH2AXおよびp53のリン酸化は、DSB修復経路の活性化に重要な役割を担うため、高感度かつ信頼性の高いDSB検出マーカーとなります(図2;6)。
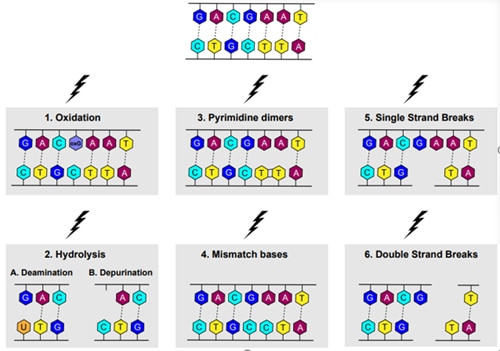
図2. 分子レベルでの様々なDNA損傷。
DNA損傷への応答
細胞にはDNA損傷に応答する3種類の手段があります。
1. 細胞老化
2. アポトーシス
3. DNA損傷の修復
DNA損傷が修復できないほど深刻な場合や、エラーの修復が不十分な場合、細胞は老化状態に入るか(加齢と関連する不可逆的な細胞周期の停止状態)、さらなる生体への被害を回避する最後の手段としてアポトーシス(プログラムされた細胞死)を開始します。
ほとんどのDNA損傷は、修復可能です。DNA損傷修復は、細胞の早期老化を防ぐだけでなく、突然変異の蓄積による悪性腫瘍の進展にも重要な意味を持っています。分子レベルでのDNA損傷修復経路と細胞の生存におけるその役割に関する研究業績によって、2015年のノーベル化学賞をTomas Lindahl氏、Paul Modrich氏、Aziz Sancar氏が受賞したことにより、DNA損傷修復というテーマに関する研究の重要性が強調されました。
参考文献
5. Srinivas et al. ROS and the DNA damage response in cancer. Redox Biol. 2018 Dec 21,101084 (2018).

