GFP-Trap®からGFP融合タンパク質を溶出する方法
GFP融合タンパク質の免疫沈降(IP)実験で選択可能な溶出方法について解説します。
クロモテックのGFP-Trap®(カタログ番号:gta)は、GFP融合タンパク質に対して非常に強固な結合性を発揮します(GFP-Trap®は、10-12M(pM、ピコモーラー)のKD値を有しており、GFPタンパク質に対して高い親和性を示します)。さらにGFP-Trap®は、最大70℃の高温下でも安定であり、厳しい洗浄バッファー条件の適用も可能です。GFP-Trap®は、以下のような厳しいバッファー組成の溶液中でもGFPタンパク質との結合性を維持することが判明しています。
- 2M NaCl
- 8M Urea(尿素)
- 0.2% SDS
様々な洗浄バッファー条件を適用できるという特徴は、非特異的な結合によるバックグラウンドの軽減に有利に働き、下流のアプリケーション用の純度の高い目的タンパク質を得ることにつながります。GFP-Trap®は、高い再現性を備え、迅速かつ高純度で回収する免疫沈降(IP:Immunoprecipitation)を実現することから、GFP融合タンパク質の単離および精製に最適な製品です。
GFP-Trap®からGFP融合タンパク質を溶出する方法:ペプチドによる競合溶出方法は利用できません。
GFP-Trap®は、GFP融合タンパク質と強固に結合することから、GFP融合タンパク質を溶出するには若干の工夫が必要です。一般的に利用されるペプチド競合溶出法を用いて溶出する場合、使用するペプチドは免疫沈降用ビーズに結合した抗体のエピトープと一致するものを使用します。添加されたペプチドは、タグ融合タンパク質と置き換わり、タンパク質と免疫沈降用ビーズとの結合は解消されます。しかし、GFP-Trap®の場合、ペプチド競合溶出法を用いてGFP融合タンパク質を溶出することはできません。GFP-Trap®に利用されているVHH抗体(Nanobody®)は、エピトープの三次元構造を認識して結合するという性質を持ちます。そのため、連続したアミノ酸配列からなる二次元構造を持つペプチドによる溶出法は効果的ではありません。また、GFP-Trap®は通常の抗体が変性してしまうような条件でも機能性を発揮し、GFPタンパク質との結合を維持します。したがって、尿素等のカオトロピック剤を使用してもGFP融合タンパク質は溶出されません。
GFP-Trap®からGFP融合タンパク質を溶出する方法:SDSサンプルバッファーまたは酸性バッファーを使用してください。
SDSサンプルバッファーを使用すると、SDSサンプルバッファーがGFP融合タンパク質を変性させ、非常に効率的にGFP融合タンパク質を溶出することができます。代替法として、pH2.5のグリシン溶液を用いる酸性バッファーによる溶出法も利用できます(インキュベーション時間:30秒/常時ピペッティングによる撹拌)。融合タンパク質の特性によっては、溶出効率に影響が出る可能性があります。GFP融合タンパク質が解離せずにアガロースビーズ上に残存している場合は、グリシン溶液による溶出ステップを繰り返し、ビーズに結合している残りのタンパク質を溶出します。酸性バッファーを用いた溶出法における一連の操作で最も重要なポイントは、溶出操作後、速やかにタンパク質溶液を中和するという点です。
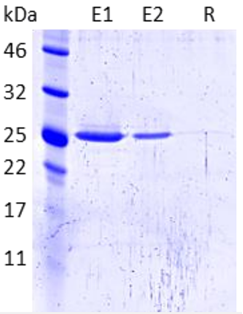
GFP-Trap® Agarose(カタログ番号:gta)を使用し、グリシン含有溶出バッファーで溶出したEGFPタンパク質(28.9kDa)の免疫沈降
その他のタンパク質溶出法:コンストラクトへのプロテアーゼ切断配列の挿入
安定性の低いタンパク質を回収する場合、GFP融合タンパク質のGFPタンパク質と目的タンパク質の配列の間に、プロテアーゼによって切断される配列を挿入する方法も選択肢の1つとなります。
最後に重要なこととして、溶出方法を考慮する以前に、GFP融合タンパク質を溶出する必要性の有無を実験ごとに確認する必要があります。ビーズに結合した状態のGFP融合タンパク質であっても、様々な実験を実施することが可能です。
- 免疫沈降後に質量分析を実施する場合、タンパク質をビーズに結合させたまま消化処理を行うことができます。(アプリケーションノート「On-bead digest protocol for mass spectrometry following immunoprecipitation with Nano-Trap[PDF]」)
- 組換え発現させたGFP融合酵素活性を測定する場合、酵素タンパク質の活性中心がビーズとの結合により阻害されていなければ、酵素タンパク質を溶出せずにそのままアッセイに供することができます。
参考資料:GFP-Trap®に結合したタンパク質の溶出方法[PDF](言語:英文)
https://www.ptglab.com/products/pictures/pdf/Application_Note_Elution_from_GFP-Trap.pdf
関連情報
What GFP-Trap should I use for my immunoprecipitation?
GFP-Trap for immunoprecipitation (IP) – stringent washing
Mass spec-compatible immunoprecipiation for GFP, mNeonGreen, Myc, RFP, Spot, and TurboGFP
GFP (green fluorescent protein): Properties, origin, specifications, tips
The best anti-GFP antibody for immunoprecipitation: GFP-Trap
Green fluorescent protein (GFP) in plant research
GFP-Booster: GFP Nanobody for better images in immunofluorescence
GFP and RFP-Booster for better immunofluorescence imaging
GFP- Nanobodies and RFP- Nanobodies conjugated to quantum dots
Learn how to save precious hours on your IP, IF, and western blotting experiments

サポート

