組換えタンパク質、サイトカイン、増殖因子の選び方
組換えタンパク質、サイトカイン、増殖因子の選び方
組換えタンパク質は、ライフサイエンス業界全体で多数のアプリケーションに使用され、一般的に細胞の正常性や増殖と関連します。組換えタンパク質の用途は、大学研究室やバイオテクノロジー系研究室での細胞培養から、バイオプロセシング、幹細胞コア、および先進治療(細胞・遺伝子治療)にまで及びます。
「組換えタンパク質」には、細胞の成長、分化、増殖を誘導する線維芽細胞増殖因子(FGF)等の増殖因子やインターロイキン2(IL-2)等の免疫調節性サイトカインが含まれます。増殖因子は、細胞の増殖や分化に直接影響を及ぼしますが、サイトカインは免疫系の調節因子で、免疫応答を惹起することで細胞の分化と活性化にも影響を及ぼします。増殖因子やサイトカインは、細胞表面の受容体に結合してシグナル伝達経路を活性化することにより、一連の作用機序を誘発するタンパク質です。しかし、すべての組換えタンパク質がサイトカインや増殖因子という訳ではありません。組換えヒト血清アルブミン(HSA:human serum albumin)は、細胞培養時に抗酸化剤および安定剤として使用できるタンパク質です。
概して、細胞を組換えタンパク質の存在下で培養すると、求められる生理的作用を目的細胞に誘導することができます。通常は機能解析前の培養細胞の正常性や増殖性、活性等と関連します。

プロテインテックのHumanKine® 等、サイトカインや増殖因子は細胞培養や治療システムで重要となるため、ご自身の細胞培養系に使用する組換えタンパク質を選択する際にはいくつかの検討事項があります。
検討事項
1. 組換えタンパク質の発現系
組換えタンパク質の産生に使用される発現系は、得られる産物に重要な影響を及ぼします。アメリカのバイオ医薬品企業Genentech(ジェネンテック)社が組換えヒトインスリンを生産するために大腸菌を使用したことは、活性を有するヒトタンパク質の開発で重要なランドマークでした。この発見から時が経ち研究が進むにつれて、活性型組換えタンパク質のニーズは変化してきました。場合によっては、タンパク質に必要とされる機能を付与するために糖鎖修飾や翻訳後修飾(PTM)が求められます。それは、真核生物の発現系のみで利用できます。こうした経緯により、昆虫細胞と哺乳類細胞(チャイニーズハムスター卵巣:CHO細胞)の両方の発現系が構築されました。ヒトへのアプリケーションや研究には、ヒト発現系が理想的です。プロテインテックのHumanKine® 組換えタンパク質は、ヒト胎児腎臓細胞(HEK293)由来です。
プロテインテックの関連製品:サイトカイン&増殖因子
2. なぜHEK発現系か?
ヒト細胞(HEK293)発現系に由来する組換えタンパク質は、CHO細胞発現タンパク質でもみられるネイティブ型の翻訳後修飾や糖鎖修飾を伴い、大腸菌等のバクテリアを宿主とする発現系のタンパク質よりも優位な点が多くあります。さらに、以下で説明するように、プロテインテックのHumanKine® タンパク質は、昆虫やCHO等の他の真核生物発現系に由来するタンパク質よりも優れています。
アニマルフリー/ゼノフリー
- 最終製品には、動物組織、体液、またはそれに由来する成分は一切含まれていません。
- 調達から最終製品に至るまでのすべての原材料は、専用のアニマルフリー施設で処理・保管されます。
- 最終製品やその生産工程では、非ヒト動物由来の原材料や非ヒト動物由来の組換え原材料を使用していません。
タグフリー
- タンパク質の発現と精製にタグを使用していません。
- タグを挿入すると目的のタンパク質の構造が変化することがよくあります。
- タグがタンパク質の活性部位に干渉し、生物学的機能が変化する場合があります。
- タグが存在することで免疫原性を示すようになるタンパク質もあるため、in vivoアプリケーションにはタグのない組換えタンパク質の方が適しています。
ヒトネイティブ型糖鎖修飾、フォールディング、成熟化
CHO細胞や昆虫細胞は真核生物の発現系ですが、ヒトタンパク質をプロセシングする多くの場合、その能力はヒト細胞の発現系と一致しません。例えば、ヒト細胞は、CHO細胞よりも成熟したactivin A二量体を産生します(図1)。
糖鎖修飾はタンパク質の安定性と機能に極めて重要な役割を果たします。CHO細胞と昆虫細胞は、この修飾過程の機構が著しく異なり、ヒトタンパク質とはまったく異なる糖鎖修飾タンパク質を産生します。
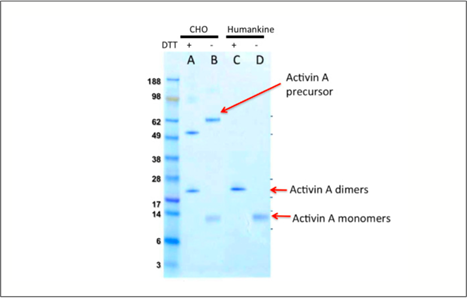 |
図1. CHO細胞発現系およびHumanKine® 発現系の精製activin Aをクーマシーブルー染色したSDS-PAGEゲル。成熟したactivin A二量体の形成が示されています。 |
高い安定性
ネイティブ型の糖鎖修飾と成熟により、ヒト細胞系で発現させたタンパク質はその他の発現系のタンパク質よりも安定性に関して非常に優れています。さらに、熱安定性を高めるように改良した、HumanKine® FGFは、大腸菌由来のFGFよりも培養時の安定性が高く(図2)、培地の交換が少なくて済みます。
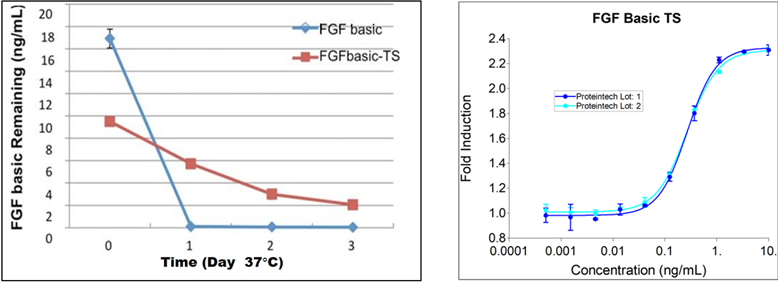 |
| 図2. プロテインテックのFGF basic-TSが競合他社の大腸菌由来製品よりも一貫して高い安定性を備えていることを示す図。無血清培地、無細胞、37℃で最大3日間安定。また、HumanKine® タンパク質は高純度でロット間の活性が一貫しています。 |
高い活性
上述した性質が相乗効果をもたらし、その他の発現系で産生されるタンパク質よりも高い活性を示す傾向があるタンパク質を産生します(図3)。
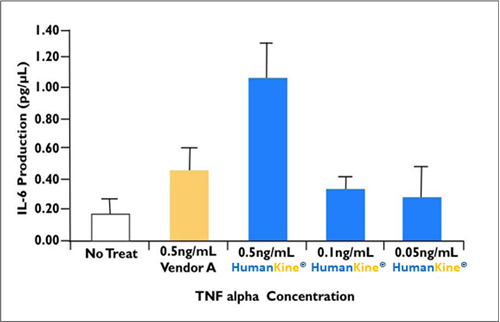 |
図3. HumanKine® TNF alphaを使用した場合、大腸菌で発現したTNF alphaと比較して、リウマチ性滑膜細胞におけるIL-6の産生効率が高いことを示しています。 |
高い純度
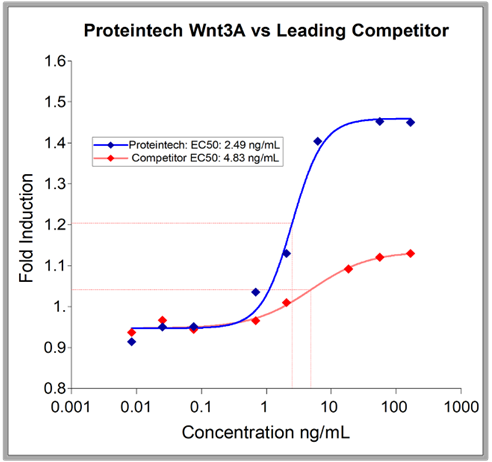
HEK293由来の組換えタンパク質は、他の発現系由来のタンパク質よりも純度が高い場合が多いです。プロテインテックのHumanKine® Wnt3aはその一例です(図4)。
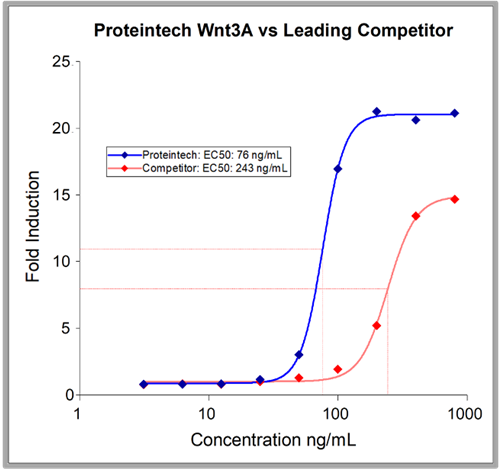 |
 |
| Wnt3AによるHEKk293レポーター細胞のルシフェラーゼ産生作用 | Wnt3Aによるマウス骨芽前駆細胞MC3T3-E1の増殖促進作用 |
| 図4. HumanKine® Wnt3Aの純度は~90%ですが、主要な競合他社の Wnt3Aの純度は70~75%です。これは、現在市販されている中で最も純度の高いGMPグレードのWnt3Aです。また、主要な競合他社の2倍以上の増殖促進作用があります(右図)。 | |
3. 製品情報
メーカーが提供する組換えタンパク質に関する様々な情報により、そのメーカーが緻密な検証を実施していること、延いては製品の品質について知ることができます。こうした情報には生物活性(バイオアッセイ検証)、純度、エンドトキシン濃度、SDS-PAGEによる検証の結果等が含まれます。
生物活性
異なるメーカーの製品を比較する場合、組換えタンパク質の生物活性が重要になる可能性があります。多くの場合、ED50やEC50(最大反応の50%を示す添加量—値が低いほど効果が高い)としてµg/mL、pg/mL等と表示されます。あるいは、unit/mgという単位で表示されていることもあります(値が大きいほど効果が高い)。
こうした濃度はアッセイ特有の値です。様々なメーカーのタンパク質の活性を比較する際には有用ですが、実際に並行評価を実施して自身のアプリケーションで機能する最適な製品を知ることが最も安全と言えます。
純度
組換えタンパク質の純度は、最終製品の総合的な品質に影響を及ぼします。可能な限り純度の高いタンパク質(>95%が望ましい)を使用し、使用製品が他の余分なタンパク質やエンドトキシン、組換えタンパク質の生理学的作用機序を阻害する可能性のあるその他の物質を含有しないと保証されていることが重要です。
エンドトキシン濃度
市販の組換えタンパク質中のエンドトキシンは、タンパク質の生物学的活性や培養細胞の活動に干渉することが知られています。LPS等のエンドトキシンは「商業的に許容できる濃度」でも、培養中の免疫細胞を活性化します(1)。購入する組換えタンパク質がエンドトキシンを含まない、あるいはエンドトキシン濃度が極めて低いことが重要です。
4. GMPグレードであるべきか?
前臨床研究から臨床研究への移行を考えている場合、GMPグレードの製品は臨床研究へのスムーズな移行を確実にするために役立ちます。臨床研究での使用を考えていない場合はRUO製品を選択してください。
プロテインテックの関連ブログ:GMPグレードの製品を購入するとどのような利点がありますか?(言語:英語)
プロテインテックのNews:ISO 13485 certification announcement(GMPグレードHumanKine®製品の詳細はこちらをご覧ください)
上述したすべての検討事項は、実験用にどの組換えタンパク質を購入するかを決定する際に重要となります。こうした情報は、どの製品がより高い性能を示し、自身のアプリケーションに最適なのかを事前に知る手掛かりとなります。実際に使用した場合に組換えタンパク質がどのように機能するか理解することも重要です。そのため、どの製品を使用するか決める前に、可能であれば最終候補の製品を並行してテストすることをおすすめします。
参考文献

