脳機能におけるエピジェネティックな関与—ニューロエピジェネティクス
環境因子、ストレス、学習、薬物への曝露は、神経系におけるDNA構造制御の活性化につながります。
ニューロエピジェネティクスについて
ニューロンの場合、エピジェネティクスの定義は完全には当てはまりません。実際に、成熟したニューロンは非分裂細胞であり、そのため、ゲノム修飾が子孫の細胞に受け継がれることはありません。このため、Day、Sweattら(1)は、古典的な遺伝性のエピジェネティクスとの違いを強調するため、「ニューロエピジェネティクス」という用語を提唱しました。
ニューロエピジェネティクスと記憶形成
ニューロエピジェネティクスの中で最も興味深いトピックの1つに、記憶の形成があります。エピジェネティクスが記憶の足場となり得るという考えから、エピジェネティクスと記憶の並列性という仮説が生まれました。ニューロンの活動によって遺伝子発現が調節を受け、この発現の変化は長期記憶に不可欠であり、エピジェネティックなクロマチンの変化にも必須となります(2)。これらの変化は、すべてがDNAメチル化による変化ではなく、ヒストン修飾も含まれます。実際に、ニューロンの活動によってヒストンアセチル化も活発になります(3)。HDAC2(ヒストン脱アセチル化酵素2)の過剰発現(図1)は、樹状突起スパイン密度の低下や、シナプス数、シナプス可塑性、記憶形成の低下を引き起こします。HDAC2の阻害によりシナプス数が増加し、記憶形成を促進することから、学習と記憶におけるヒストンアセチル化の役割が確認されています(4)。CREB結合タンパク質(図2)は、CREB/p300 HAT(ヒストンアセチル化転移酵素)の機能を制御しており、その変異は精神遅滞を引き起こしますが、HDAC阻害剤によって改善が認められています(5)。
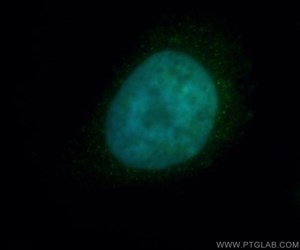
図1. HDAC2抗体(カタログ番号:12922-3-AP、希釈倍率1:50)と、FITC標識ロバ抗ウサギIgG抗体(緑)を用いた、Hela細胞の免疫蛍光染色解析像。青(疑似色):DAPI(DNA染色蛍光色素)。
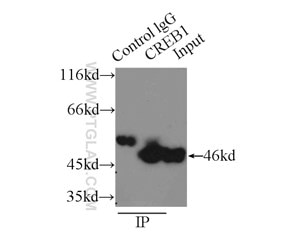
図2. HEK-293細胞ライセート2000µgと抗CREB1抗体(カタログ番号:12208-1-AP、IP:3µg、検出:希釈倍率1:600)によるIPの結果。
中枢神経系(CNS)と5'-ヒドロキシメチルシトシン(5-hmC)
中枢神経系(CNS:central nervous system)では、末梢組織や胚性幹細胞(ES細胞)と比較すると、脳中の5-hmC量は10倍多くなっています。さらに、ES細胞と比較した場合、脳内における5-hmCが存在するゲノム上での位置は、ES細胞とは異なる箇所にあると示唆されています。5-hmCは、ES細胞の多能性関連遺伝子のエンハンサーやプロモーターに優先的に認められる一方(6)、脳内では遺伝子本体に多く認められ、転写開始部位(TSS:transcription start site)では枯渇しています(7)。ついには、活性化している転写ユニット内の5-hmCとMeCP2の相関関係を示す研究(8)によって、ニューロエピジェネティクスの認識が広がり、さらに答えの出ない問題を提起しています。
ヒストン脱アセチル化酵素(HDAC)と脳の発達
ヒストンのアセチル化は、成体の脳の発達で際立って重要な役割を果たします。例えば、p300タンパク質とその近縁のホモログであるCBPは、ヒストンアセチル化転移酵素(HAT)活性を有する転写共役因子であり、CREB、SRF、MEF2、C-JUNを含む様々な転写因子の活性に関与します(図3)。CBP/p300は、発達中の神経管全体に広く分布していますが、成体の中枢神経系では大部分が皮質細胞と運動ニューロンの亜集団に限定されています。CLOCKは、HAT活性を有する特殊なタンパク質で、視床下部の視交叉上核(SCN:suprachiasmatic nucleus)中の主要な概日時計遺伝子が適切に発現するための基盤となり、概日リズムの周期性を維持する基礎となるタンパク質です。HATと対になる脱アセチル化酵素(HDAC)は、神経系で発現しており、多くの場合、発達の進行に伴い調節を受ける仕組みによって発現しています(9)。HDAC1は、神経幹細胞やグリアに限定されているのに対し、HDAC2は主に有糸分裂後の神経芽細胞や分化したニューロンに存在しています。
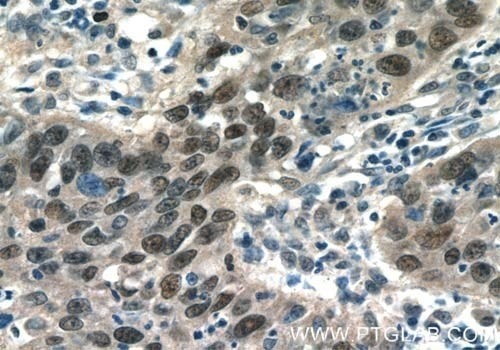
図3. C-JUN(AP1、p39)抗体(カタログ番号:10024-2-AP、希釈倍率1:50)を使用した、パラフィン包埋ヒト子宮頸がん組織スライドの免疫組織化学染色(40倍レンズを使用)。
ヒストン修飾と脳の活動
脱分極刺激の後、Ca2+依存性シグナル伝達カスケードは、CBPのリン酸化を誘導し、プロモーターをアセチル化します(10)。同時に、ヒストンH3のSer10のリン酸化は、ヒストンアセチル化と協同してクロマチンのアンフォールディングとそれに続く遺伝子発現を誘導します。さらに、Bdnf等の神経細胞の遺伝子は、リシン脱メチル化酵素であるLSD1(図4)、HDAC2、MeCP2のリクルート等のメカニズムを介して抑制状態に維持されます。シナプス刺激後、HDAC2や、おそらくHDAC1はS-ニトロシル化(SNO)され、一方でMeCP2はリン酸化されることで、遺伝子制御領域からのコリプレッサー複合体の解離と、転写開始部位(TSS)での共役因子(例:CBP)のリクルートに至ります(図5)。
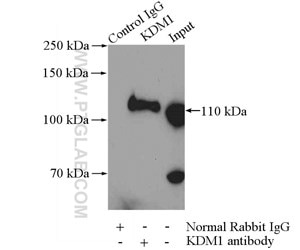
図4. HeLa細胞ライセート2000µgと抗LSD1(KDM1)抗体(カタログ番号:20813-1-AP、IP:4µg、検出:希釈倍率1:600)によるIPの結果。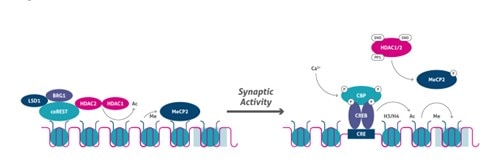
図5. 活動依存性のエピジェネティックな制御。
最後に
上述した例は、エピジェネティクスが神経系に重要な役割を果たしていることを示唆していますが、その干渉機構はまだ十分に解明されていません。神経系の高度な複雑性は、制御機構のエピジェネティックな障害に非常に感受性が高いことを意味します。このため、障害の影響は、レット症候群(RTT)、ルビンシュタイン・テイビ症候群(RTS)、脆弱性X症候群、アルツハイマー病等の神経疾患に反映されている可能性があります。
参考文献

