ヒントとコツ | 免疫蛍光染色(IF)実験を最適化するための9つのヒント
免疫蛍光染色(IF)実験でより良い結果を得るためのポイントを解説します。
概要
|
免疫蛍光染色(IF)とは? ポイント: 5. 一次抗体の宿主(免疫動物)とは異なる動物種由来の血清をブロッキングに使用してください。 |
免疫蛍光染色(IF)とは?
免疫蛍光染色(IF)とは、細胞や組織の形態が維持された状態のサンプルにおいて、抗体を用いてタンパク質やその他の抗原を検出し、局在を確認するための手法です。
IFは十分に確立された手法ですが、実験を開始する前に推奨されるいくつかの検討事項が存在します。
IFのポイント1:サンプルに適した固定剤を使用してください。
汎用的な固定剤は、アルデヒド系と有機溶媒系の2種類に大別されます。
アルデヒド(ホルムアルデヒドやグルタルアルデヒド)は、膜結合性抗原と細胞骨格抗原の二重免疫染色に適しています。また、核タンパク質やミトコンドリアタンパク質を対象とする場合にもおすすめです。
|
推奨される固定ステップ: 2~4% PFA(パラホルムアルデヒド)を使用して、室温で10~20分間インキュベーションします(図1)。 |
注意点:
化学的架橋を原理とするアルデヒド系による固定方法は、タンパク質が化学的に修飾を受けることで、抗原が変性する可能性があります。
アルデヒドを使用した固定操作では、アルデヒドとアミン類やタンパク質の反応によって生じる自家蛍光を低減するための「クエンチング」ステップが必要になる場合があります。
また、組織サンプルを使用する場合の固定処理は、培養細胞サンプルよりも長時間実施する必要があります。
有機溶媒系(メタノール、エタノール、アセトン等)を用いた固定法は、脱水作用とタンパク質の凝固・沈殿作用を介して組織や細胞を固定します。有機溶媒系は、タンパク質構造の内部にある単一のエピトープと結合するモノクローナル抗体を使用する場合に推奨されます。
メタノールは、凍結サンプルを用いる際に最適な固定剤です。メタノールは細胞構造を維持し、タンパク質の二次構造を安定化します。しかし、水溶性成分と脂質成分が失われるという懸念点があります。
アセトンは強力な脱水剤であり、組織タンパク質を不可逆的に凝固・沈殿させます。サンプルを組織学的に維持したい場合は、メタノールよりもアセトンの方が適しています。メタノールやアセトンを使用する場合、追加の透過処理ステップを行う必要はありません。
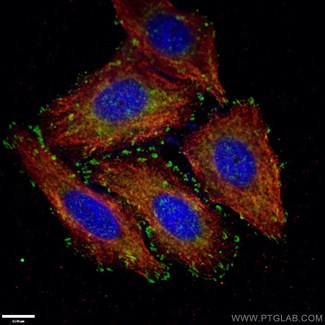 |
|
図1. パキシリン抗体(カタログ番号:10029-1-Ig、希釈倍率1:50、緑色)およびAlexa Fluor 488標識AffiniPureヤギ抗ウサギIgG(H+L)抗体による-20℃エタノールで固定したHepG2細胞の免疫蛍光染色。細胞骨格はα-チューブリン抗体(カタログ番号:66031-1-Ig)を用いて標識した。青:DAPI染色。 |
IFのポイント2:目的物質の染色に適した界面活性剤を選択してください。
—アルデヒド系の固定剤を使用する場合は、抗体が細胞内へ到達できるように細胞の透過処理が必要です。
—有機溶媒系(メタノールやアセトン)の固定剤を使用した場合は、透過処理ステップは不要です。
アルデヒドによる固定後に透過処理を行わない場合、抗体は細胞膜を通過することができません。細胞質内の目的物質にアクセスさせるためには、ジギトニン(Digitonin)、Leucoperm™(ロイコパーム)、サポニン(saponin)等の穏やかな作用を示す界面活性剤が必要です。さらに、膜系細胞小器官(例:核、ミトコンドリア等)内の目的物質を染色するには、Triton X-100、NP-40等のより強い作用を示す非イオン性界面活性剤の使用が推奨されます(図2)。
|
推奨される透過処理ステップ: —細胞質ゾルに目的物質がある場合:0.5~1mg/mLの濃度の穏やかな作用を示す界面活性剤を使用して、室温で10~30分間インキュベーションします(界面活性剤はDMSOに溶解したストック溶液として調製しておきます)。 —膜系細胞小器官内に目的物質がある場合:0.1~0.2%のTriton X-100 PBS溶液を使用して、室温で10分間インキュベーションします。 |
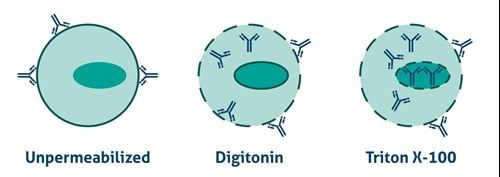 |
|
図2. 透過処理を行っていない細胞、ジギトニン(穏やかな作用を示す界面活性剤)で透過処理を実施した細胞、Triton X-100(より強い作用を示す非イオン性界面活性剤)で透過処理を実施した細胞におけるそれぞれの抗体のアクセス性。 |
注意点:
また、SDSは固定処理した細胞をわずかに変性させ、マスクされていることによって抗体が認識できない可能性のあるエピトープを露出させるために有用な透過処理剤です。SDSは、サイズが小さく、架橋度合いの低いタンパク質を露出させることができます。しかし、アルコール系の固定剤(凝固・沈殿による固定剤)を使用したサンプルには使用できません(例:メタノールを用いた固定)。
IFのポイント3:適切なコントロールを設定してください。
適切な陰性コントロールを使用して、染色の特異性を検証してください。
例:
—二次抗体だけで染色したスライド(バックグラウンドシグナルの閾値を決定します)
—目的の抗原を発現していない細胞/組織スライド
IFのポイント4:抗体の希釈倍率と細胞密度を最適化してください。
染色を行う際に約50%コンフルエントになるように細胞数を調整します。
—細胞密度が高すぎる場合、細胞の構造が変形し低倍率時にバックグラウンドが高くなるおそれがあります。
—細胞密度が低すぎる場合、細胞集団内の典型的なパターンを観察できるフィールドを見つけるのに労力を要します。
特殊なコーティングが必要となる場合
—非接着性細胞や低接着性の細胞は、ガラス表面上で増殖させることが困難です。このような場合、ポリリジンや細胞外マトリックス(例:コラーゲン、ラミニン)等でコートしたカバーガラスを使用します。
—いくつかの組織(例:血管や脳等のサンプル)は、複数回の洗浄ステップ後においてもスライドガラスへの接着性が維持されるように、ゼラチンコートのスライドガラスやポリリジンコートのスライドガラスを必要とする場合があります。
注意点:
純度の高い抗体1µg/mLまたは希釈倍率1:100~1:1000の抗血清であれば、特異的な染色像を得るために十分な抗体濃度でしょう。まずは抗体価測定実験を実施して、希釈倍率を最適化することを推奨します。
IFのポイント5:一次抗体の宿主(免疫動物)とは異なる動物種由来の血清をブロッキングに使用してください。
ブロッキングバッファーとして、1~5% BSA(ウシ血清アルブミン)、粉乳(スキムミルク)、血清を使用して、室温で1時間インキュベーションすることを推奨します。
注意点:
ブロッキング剤は、一次抗体を産生させた動物種(免疫動物)とは異なる由来のタンパク質であることが重要です。一次抗体の免疫動物に由来するタンパク質や血清をブロッキング剤として使用した場合、その実験系において、二次抗体は一次抗体に対する特異性を喪失します。そのため、血清をブロッキング剤に使用する際は、二次抗体の産生動物種(免疫動物)と同じ由来の血清を選択してください。
例えば、マウスの免疫グロブリンを免疫原に用いてヤギで産生された二次抗体を使用する場合は、ヤギ由来正常血清がブロッキング剤として適しています。
IFのポイント6:一次抗体および二次抗体を最適化しましょう。
一次抗体のインキュベーションは、室温で1〜2時間、または4°C、暗所でオーバーナイト(ON:over night)の条件で通常は実施されます。
また、一次抗体と二次抗体は、いずれもブロッキングバッファーで希釈する必要があります。
—直接法では、一次抗体にあらかじめ蛍光色素が標識されているため、一次抗体のインキュベーション後にサンプルのマウントを実施します。
—間接法では、一次抗体のインキュベーション後に、蛍光標識された二次抗体を結合させるステップが必要となります。
注意点:
間接法を行う際は、一次抗体のインキュベーション後に徹底的な洗浄を行い、二次抗体の非特異的な結合を軽減することが非常に重要なポイントとなります。
IFのポイント7:多重染色の手順を検討しましょう(オプション)。
—多重染色に用いる各一次抗体は、それぞれ異なる動物種由来の抗体を使用する必要があります。そうすることで、検出チャンネルの異なるフルオロフォア(蛍光色素)を標識した二次抗体をそれぞれの一次抗体に結合させて、シグナルを検出することが可能になります。
—別の方法として、連続的なインキュベーションによってサンプルの二重染色を実施することも可能です。その場合、まず1番目の抗原に対してブロッキング、一次抗体、および二次抗体によるインキュベーションを一通り実施してから、その後2番目の抗原に対してこれらの操作を繰り返します。
IFのポイント8:細胞構造の特定を容易にするため、対比染色を実施してください。
対比染色は、2つの異なる目的のために行われます。
—バックグラウンド蛍光を軽減するため
—細胞小器官を特定し、シグナルの局在に関する情報を得るため
最も一般的な核対比染色用色素は、DAPI(ジアミジノ-2-フェニルインドール)、Hoechst 33342、ヨウ化プロピジウム(PI)、DRAQ5です。
核の対比染色に推奨されるインキュベーション法:
0.1〜1μg/mLの核染色用色素を使用して、室温で5分間インキュベーションします。その後、PBSを用いて徹底的な洗浄を実施します(図3)。
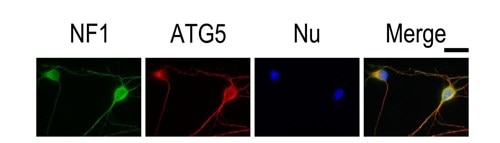 |
|
図3. E15(15日齢)マウスの皮質ニューロンを使用した抗ATG5抗体(カタログ番号:10181-2-AP、1:50)によるIFの結果。細胞をNF1抗体(緑色)により共染色し観察を行った(40倍レンズを使用)。細胞は4% PFAで固定し、0.2% Triton X-100を用いて透過処理した。 |
IFのポイント9:サンプルを適切にマウントしましょう。
一滴の封入剤とカバーガラスを用いて、組織サンプルをマウントします。次に、サンプルをマニキュア液で密封し、顕微鏡下での乾燥やズレを防ぎます。顕微鏡解析後は-20°Cまたは4°Cの暗所に保管することをおすすめします。
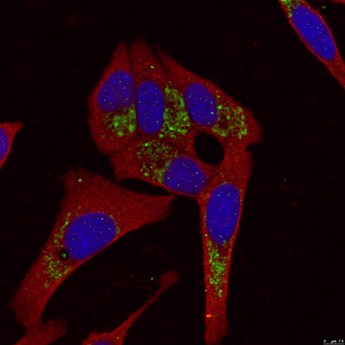 |
|
図4. LC3B-Specific抗体(カタログ番号:18725-1-AP、希釈倍率1:200、黄緑色)およびCoraLite488標識AffiniPureヤギ抗ウサギIgG(H+L)抗体を使用した、-20℃エタノール固定・CQ処理HepG2細胞の免疫蛍光染色。 |

