脳オルガノイド研究の紹介
脳オルガノイドの材料や作製方法、従来の動物モデルとの違い、どうして生命科学研究に革命をもたらすと言われているのか等について詳しく解説します。
Ryszard Wimmer著(ソルボンヌ大学(フランス)博士課程在籍)
「オルガノイド(Organoid)」は、動物モデルを作成することなくヒトの臓器/器官の発生モデルを構築できることから、現在世界中で盛んに研究が行われている分野の1つです。オルガノイドの研究は、iPS細胞等の幹細胞研究から始まり、研究者はすでにオルガノイドを使用して複雑な生理機能を再現できるようになっています。オルガノイドの示す特性は前途有望であり、より複雑で完全に発達したモデルを樹立できるかもしれない大きな可能性を秘めています。プロテインテックは、フランスパリのソルボンヌ大学で博士課程に在籍し脳オルガノイドを研究する学生である、Ryzard Wimmer氏と共同で本ブログ記事を執筆しました。本稿では、研究におけるオルガノイドの歴史や利用法に注目し、オルガノイドの培養方法、およびイメージング解析を実施する際のヒントとコツを紹介します。
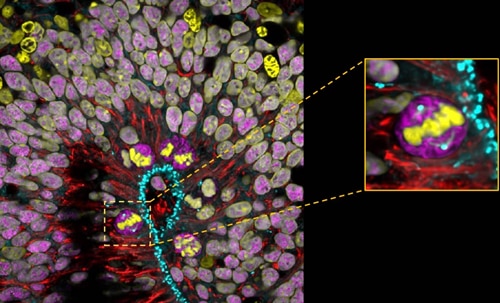
7週間経過したヒト背側大脳オルガノイド。サンプルは4% PFAで固定しました。赤い箇所はSyne-2/Nesprin 2抗体(カタログ番号:25265-1-AP、希釈倍率1:500)で染色された部分です。頂端放射状グリア細胞(aRGC:Apical Radial Glia cell)は、細胞核の往復運動(Interkinetic Nuclear Migration)を行い、脳オルガノイドの脳室帯様領域で分裂します。拡大図(図右側の枠内):紡錘体の完成した分裂中期のaRG細胞(撮影:Wimmer Ryszard、PSL研究大学・キュリー研究所、フランスパリ)。
オルガノイドはどのような目的で使用されるのか?
従来より、マウスモデルのような動物モデルは、ヒトの発生や疾病における特定の研究テーマに取り組む際に困難を伴う研究モデルでした。動物モデルを使用するにあたって直面する厄介な問題はよく知られており、動物モデルがヒト組織や疾病を再現できる最良のモデルではないといった問題点が含まれます。このような問題に取り組むために、研究者はヒト幹細胞由来の3Dモデルを作成する方法を開発しています。ハーバード大学幹細胞研究所のウェブサイトの特集では、「オルガノイドは、幹細胞に由来する小さな自己組織化された三次元組織培養物であり、このような培養物は、器官(臓器)の複雑性を再現する目的で、または、特定の種類の細胞の産生等といった器官(臓器)の選択的な側面を反映するように構築される。」と定義されています1。そのため、オルガノイドはin vivo組織の細胞構造とその機能の一部を再現します。現在のところ、オルガノイドには血流やホルモン、その他の臓器との相互作用等を含む外部に接続された際の生理学的条件の入力が欠如していることから、オルガノイドは「真」の機能を発揮する臓器を代表するモデルとまではいえません。しかし、オルガノイドを使用することで、様々な処理や生理学的条件の入力に応答した反応を観察できることから、胎生期から出生後に至るまでのヒト臓器の発生に関する基礎研究が可能になります。すなわち、オルガノイドは、初代培養細胞や株化細胞よりも複雑なレベルで基礎的な細胞生物学を理解するのに役立つ優れたモデルであり、in vivo組織に対する大きな洞察を提供します。また近い将来、オルガノイドを特定の組織の損傷治療やがんの治療に使用できるのではないかと、研究者達は期待を抱いています。
オルガノイドはどのような細胞から作製されるのか?
2000年代半ばに、山中伸弥博士と研究チームは人工多能性幹細胞(iPS細胞、induced pluripotent stem cells)の作製法の発見という画期的な偉業を成し遂げました。研究チームは、線維芽細胞等の分化した体細胞では通常抑制されている特定の遺伝子を発現させることで、皮膚細胞を胚性幹細胞様の状態に転換できることを発見しました2。オルガノイドは、主にiPS細胞を使用して作製され、iPS細胞は内胚葉、中胚葉、外胚葉の3種類の一次胚葉から派生する細胞に分化します。異なる増殖因子のカクテルを添加し、異なるマトリックス中で培養することで、iPS細胞を単一細胞やコロニーとして培養することが可能であり、培養条件の違いによって3種類の胚葉層に変換することができます。現時点で最も特性解析が進み、最も利用されているオルガノイドには、腸、心臓、筋肉、および大脳(脳)のオルガノイドが挙げられます。
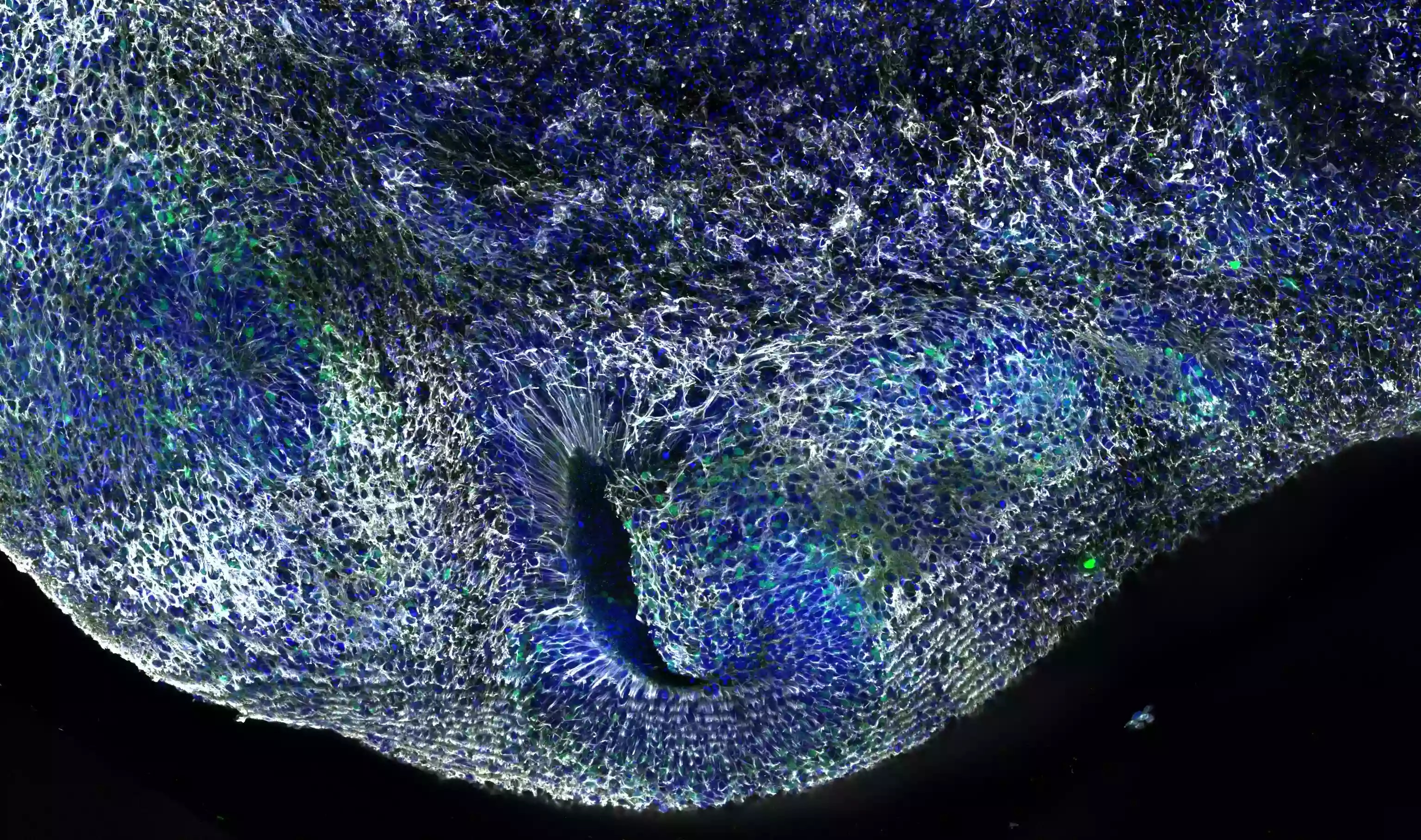
12週間経過したヒト背側大脳オルガノイド。サンプルは4% PFAで固定しました。白い箇所はSyne-2/Nesprin 2抗体(カタログ番号:25265-1-AP、希釈倍率1:500)で染色された部分です。核染色にはDAPI(希釈倍率1:1000)を使用しました(撮影:Wimmer Ryszard、PSL研究大学・キュリー研究所、フランス)。
脳オルガノイドの種類
遺伝子配列や転写産物のシーケンス技術が発展し、大脳皮質の発生を研究する分野に適用されることにより、オルガノイドの運命決定に関わる様々な因子の発見が可能になりました。判明した転写因子のカクテルを使用して未分化細胞を培養すると、研究対象となる脳の領域に酷似した様々なオルガノイドを得ることができます。様々なオルガノイドへの分化については、スタンフォード大学のSergiu Pasca博士の研究グループが背側大脳オルガノイド、脊髄オルガノイド、筋肉オルガノイド等の様々なオルガノイドモデルを作製し、実際に論文を発表しています。驚くべきことに、研究グループはオルガノイドモデルである3種類のスフェロイドから、大脳皮質による筋収縮の制御を再現できる「集合体(assembloid、アセンブロイド)」を構築することに成功しました3。その他の興味深い一例には、ケンブリッジ大学のMadeline Lancaster博士のラボの成果が挙げられます。博士の研究チームは脳脊髄液(CSF:Cerebral spinal fluid)を分泌する脈絡叢オルガノイドを作製しています4。このような機能モデルに関する報告は、理論上では、適切な複数の因子を添加して未分化細胞を培養することで、目的の脳オルガノイドのモデル作製が可能であるという壮大な可能性を浮き彫りにしています。脳オルガノイドは、ヒトの神経系や神経発生条件、神経疾患等を正確にモデル化できるかもしれないという技術的価値を秘めており、これからの神経科学の研究分野にとって大きな意味を持つと言えます。
大脳オルガノイドの作製プロトコールと維持法
ウェスタンブロット(Western blot)やパッチクランプ法等の数多くの実験プロトコールと同様に、大脳オルガノイドのプロトコールには様々な種類があり、多くの場合は各ラボに特有のプロトコールです。第一に、Lancasterプロトコール4やSergiu Pasca博士のプロトコール5が有名で、多くのラボで用いられています。オルガノイドのプロトコールで最も重要なポイントは、正常なiPS細胞集団を使用するという点です。iPS細胞は非常に繊細であり、定められた培養条件で維持されなければなりません。例えば、二酸化炭素濃度、湿度、温度、培地条件等がほんのわずかに変化するだけでも、培養するオルガノイドにばらつきが生じるおそれがあります。
培養するオルガノイドのサイズも、オルガノイドを長期的に培養維持する際に重要なポイントとなります。長期間培養して、オルガノイドの体積が増加すると、酸素供給の問題を原因とする中心壊死が生じ始めます5。したがって、中心壊死を防止し正常な培養物を維持するには、数週間おきにオルガノイドをスライスして培養することを推奨します。
大脳オルガノイドの培養に関する情報やヒントについては、Michela Barabato氏(エジンバラ大学シニアリサーチテクニシャン)が解説するウェビナーをご覧ください(こちらから視聴できます(言語:英語))。
オルガノイドをイメージングする際のヒント
実際にイメージングを実施する際のオルガノイドの準備は、目的とする実験で必要となるイメージングの種類や解析法の種類によって異なります。例えば、ライブイメージングを実施する場合はオルガノイドを比較的厚く切り出しますが、免疫蛍光染色(IF:Immunofluorescence)を実施する場合は、抗体が浸透しやすいよう、より薄い薄片にスライスしてから固定処理する方が良好な結果を得られます。生組織イメージングを実施する場合は、作動距離の大きな対物レンズを用意しておくと良いでしょう。また、広視野スピニングディスク型共焦点顕微鏡を使用すると、生組織イメージングに関する問題を解消し、所要時間を短縮することができます。細胞の種類ごとに詳しく解析したい場合は、40x対物レンズや60x対物レンズの使用が推奨されます。免疫蛍光染色イメージングの問題を解決するためのポイントがまとめられている資料が数多く存在しますが、どのような場合でもおすすめできることは、洗浄ステップの回数と洗浄時間を増やすことです。サンプルを洗浄すれば洗浄するほど、良好な画像を得られる傾向にあります。
オルガノイド培養に使用される「HumanKine®(ヒューマンカイン)」増殖因子
ヒトiPS細胞を正常な状態に維持するには、高品質かつ信頼性の高い試薬を使用することが非常に重要となります。HumanKine®(ヒューマンカイン)組換えサイトカインおよび増殖因子は、HEK293細胞で発現させた「本物」のヒトタンパク質であり、大腸菌発現系タンパク質よりも高い活性を示します。また、HumanKine®のタンパク質は、タグフリーおよびエンドトキシンフリーの組換えタンパク質です。
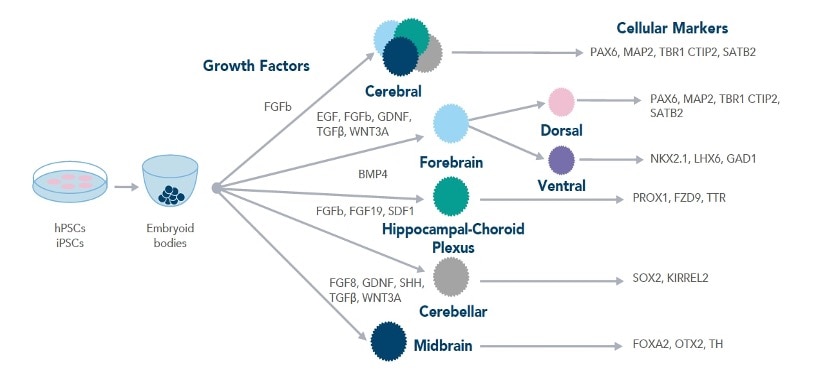
異なる種類の脳オルガノイドに分化させるために必要な増殖因子を示したワークフロー
オルガノイド作製に利用される「HumanKine®(ヒューマンカイン)」増殖因子
タンパク質名 |
純度 |
活性(EC50) |
発現系 |
モデル
|
cGMPグレード
|
| BMP4 | >95% |
1.5-9 ng/mL |
HEK293 |
海馬‐脈絡叢 |
〇 |
| EGF | >95% |
0.1-0.6 ng/mL |
HEK293 |
皮質 |
- |
| FGFb | >95% |
0.05-0.4 ng/mL |
HEK293 |
皮質、小脳 |
〇 |
| FGF8 | >95% |
≤ 10 ng/mL |
HEK293 |
中脳 |
- |
| GDNF | >95% |
≤ 10 ng/mL |
HEK293 |
中脳、視床下部、前脳 |
- |
| SHH | >90% |
≤ 350 ng/mL |
HEK293 |
中脳 |
- |
| TGF | >95% |
≤ 0.5 ng/mL |
HEK293 |
中脳、視床下部、前脳 |
〇 |
| WNT3A | >90% |
1-17 ng/mL |
HEK293 |
中脳、視床下部、前脳 |
〇 |
オルガノイドの特性解析に利用される抗体
ターゲット |
細胞/組織 |
ターゲット |
細胞/組織 |
|
皮質深層ニューロン |
前脳腹側 |
||
|
新生ニューロン |
中脳細胞 |
||
|
神経幹細胞、前脳 |
放射状グリア/神経幹細胞 |
||
|
前脳、神経幹細胞 |
海馬ニューロン |
||
|
中間前駆細胞(Intermediate progenitor) |
プレプレート/Cajal-Retzius細胞 |
||
|
中脳ドーパミン作動性ニューロン |
脳梁交連皮質ニューロン |
||
|
前脳細胞 |
放射状グリア/神経幹細胞 |
||
|
皮質前駆体、海馬ニューロン |
プレプレート/Cajal-Retzius細胞 |
||
|
前脳腹側 |
中脳神経幹細胞 |
||
|
小脳前駆細胞 |
脈絡叢 |
||
|
前脳腹側 |
ニューロン |
||
|
神経幹細胞、移動ニューロン、神経板 |
GABA作動性ニューロン・グリシン作動性ニューロン |
||
|
神経幹細胞、ニューロン |
放射状グリア/神経幹細胞 |
||
|
神経幹細胞、GABA作動性介在ニューロン前駆体、オリゴデンドロサイト |
参考文献
- https://hsci.harvard.edu/organoids
- K Takahashi, S Yamanaka, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 2007 Nov 30;131(5):861-72.
- J Andersen, S P Paşca, et al. Generation of Functional Human 3D Cortico-Motor Assembloids. Cell. 2020 Dec 23;183(7):1913-1929.e26.
- L Pellegrini, M A Lancaster, et al. Human CNS barrier-forming organoids with cerebrospinal fluid production. Science. 2020 Jul 10;369(6500):eaaz5626.
- S A Sloan, S P Pașca, et al. Generation and assembly of human brain region-specific three-dimensional cultures. Nat Protoc. 2018 Sep;13(9):2062-2085.

