げっ歯類の初代神経細胞(ニューロン)の培養を成功させるための7つのヒント
プロテインテックの研究者が、完全性を維持した初代神経細胞(初代ニューロン)の培養を成功させる7つのポイントを解説します。
初代神経細胞(初代ニューロン)は、細胞の機能、タンパク質相互作用、神経毒性等を研究するための強力なツールであり、多数のin vitroアプリケーションを支えています。神経細胞を培養する上で最大の課題となるのは、得られる細胞数が少ない点と生存率向上のための細胞死の管理です。神経細胞の前処理(採取・培養)手順の最適化は、時間と費用を要する作業です。そこで本稿では、初代神経細胞の培養を飛躍的に改善する7つのポイントを解説します。
- 適切な培養基質・コーティング剤を使用する
- 胎仔組織を使用する
- 組織を完全に解離させる
- 適切な物質を添加した無血清培地を使用する
- 実験に適した細胞密度を把握する
- 迅速に作業する
- 培養細胞が新たな環境に適応することを待つ
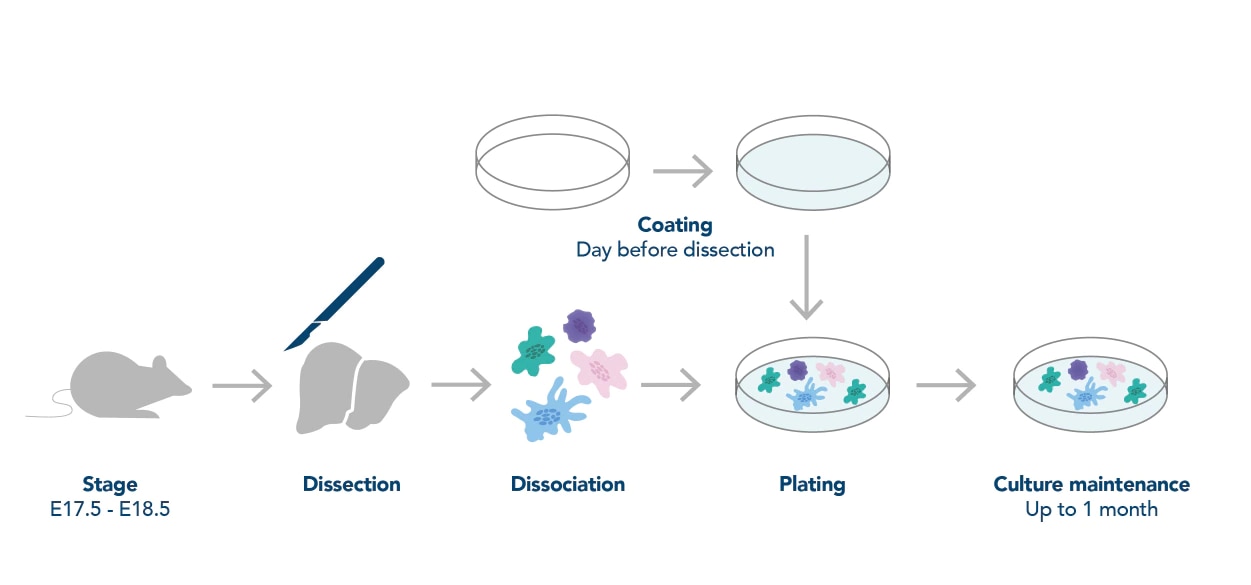
図1. 神経細胞前処理(採取・培養)の一般的なワークフロー(Deshpande, et al.(2016)より引用)
-
適切な培養基質・コーティング剤を使用する
プラスチックやガラス製の培養容器に神経細胞を接着させて単層で培養する際、無血清培地を使用する場合は特に、細胞外マトリックス成分やその他の接着因子を必要とします。使用する神経細胞が培地中で適切に接着・分化・成長できるように、細胞を播種する前に1種類または複数の培養基質や添加物質で培養プレートをコーティングします。神経細胞の培養で最も一般的に使用されるコーティング物質には、ポリ‐D‐リジン、ポリ‐L‐リジン、ポリ‐L‐オルニチン、フィブロネクチン、コラーゲン、ラミニン等が挙げられます。多くの実験では、ポリ‐D‐リジンやポリ‐L‐リジンがよく使用されています。鎖長の短いポリマーは細胞に対する毒性を示すため、ポリ‐L‐リジンを使用する場合は分子量の大きいもの(>MW 30,000~700,000)を選択するよう留意します。さらに、細胞が不均一に増殖、または凝集しないように、培養ウェルの底面全体がコーティング物質で被覆されているか確認します。コーティング物質の残渣は神経細胞に対する毒性を有することから、細胞を播種する前に余分なコーティング剤は完全に除去します。
-
胎仔組織を使用する
神経細胞を培養する際は、未発達な実験動物(胎仔組織)から目的細胞を採取するのが最善です。胎仔(胎生16~18日目)の脳内に存在する神経細胞は、神経突起の伸長や細胞間のネットワーク形成が未発達であるため、細胞解離中のダメージを受けにくい性質を有します。また、胎児の脳には数多くの未分化な細胞が存在します。適切な培地で培養すると、未分化細胞は神経細胞へ分化し、すでに分化した細胞を培養するよりも容易に目的細胞を得ることができます。対照的に、成長が進んだ脳組織は複数の種類の細胞が混在する不均一な組織であるため、アストロサイト(星状膠細胞)やオリゴデンドロサイト(希突起膠細胞)のような異なる種類の細胞が培養時にコンタミネーション(混入)する場合があります。
-
組織を完全に解離させる
神経細胞を採取する際は、酵素的手法、化学的手法、機械的手法を組み合わせて適切に組織から細胞を解離することが重要となります。組織が適切に解離できていない場合、細胞が凝集したままになり、培養中に神経細胞が適切に細胞間のコネクションを形成できないおそれがあります。適切な細胞の解離のために、組織を採取後、小さな細片への細断を推奨します。さらに、細胞を解離するために使用する酵素の種類についても検討します。例えば、コラゲナーゼはトリプシンよりも作用が穏やかで、処理時間が長くなる場合があります。
-
適切な物質を添加した無血清培地を使用する
血清を培地に添加すると、前駆細胞がアストロサイトに分化してしまう等、培養細胞が目的の細胞とは異なる細胞へ分化誘導されてしまう場合があります。神経細胞を培養するために最適化された専用培地や各種添加物質が市販されています。細菌のコンタミネーションを防ぐために、ペニシリン‐ストレプトマイシン‐グルタミン混合液のような、適切な抗生物質を培地に添加します。さらに、神経細胞を最初に播種する際は、少量のL‐グルタミン酸(~0.025mM)を培地に添加しておくと、神経細胞の増殖と細胞間のネットワーク形成が促進されます。その際、L‐グルタミン酸による細胞毒性の作用が実験に影響を及ぼさないように、培地中のL‐グルタミン酸濃度や培養時のL‐グルタミン酸への暴露時間は、細胞毒性を示さない程度の濃度・時間に止めるよう留意します。最後に、正常な状態をできるだけ長く維持するためには、3日おきに培地の半量を交換することを推奨します。
-
実験に適した細胞密度を把握する
培養細胞の状態を健常に保つには、神経(ニューロン)細胞を適切な密度で播種することが重要となります。細胞を高密度に播種した場合も、低密度に播種した場合も、細胞凝集が生じ、わずか数日間培養しただけで球状の細胞塊が発生します。一般的な目安としては、1,000~5,000 cells/mm2程度の密度になるように細胞を播種します。最適な培養細胞の密度は、実験内容に依存します。例えば、個別の細胞のイメージング画像を撮影する場合は、細胞の密度が低い方が細胞同士の重なり合いが少なくなり明瞭な画像を撮影できます。一方、発現量の低いタンパク質のウェスタンブロット(WB:Western blot)を実施する際は、1度の培養で多くの細胞が得られるように、細胞密度を高くした方が良い場合があります。
-
迅速に作業する
神経細胞の採取作業を開始すると、細胞には負荷がかかり、死滅するリスクが高い状態になります。したがって、迅速かつ効率的に作業を進めることが重要となります。神経細胞の採取を開始する前に、使用する溶液や器具の準備をすべて整えておきます。さらに、細胞を急激な温度変化に曝さないために使用する溶液をあらかじめ加温する、組織の解離速度を加速させるために酵素処理をする際は組織を37℃のインキュベーターに置く等の操作を検討します。
-
培養細胞が新たな環境に適応することを待つ
細胞播種後は細胞の状態を確認したくなりますが、神経細胞は置かれた環境に非常に敏感です。温度変化や撹拌によって細胞に負荷がかかり、成長・増殖が妨げられる可能性があります。できる限り細胞を静かな状態に保ち、培地交換や実験を行う時だけ培養容器を動かすようにします。
神経細胞の前処理(採取・培養)プロトコールを最適化すれば、免疫細胞化学(ICC:Immunocytochemistry)、ウェスタンブロット(WB)、ELISA、フローサイトメトリー等のin vitro実験に培養細胞を利用することができるようになります。プロテインテックは、様々な実験手法に利用可能な抗体を幅広く取り揃えています。未標識抗体の他にも、蛍光色素標識抗体やビオチン標識抗体、抗体と試薬がセットになったIHC用キット「IHCeasy」等、多数の製品を取り揃えています。以下の表には、プロテインテックが販売する成熟神経細胞(ニューロン)マーカー用の抗体をまとめています(表1)。
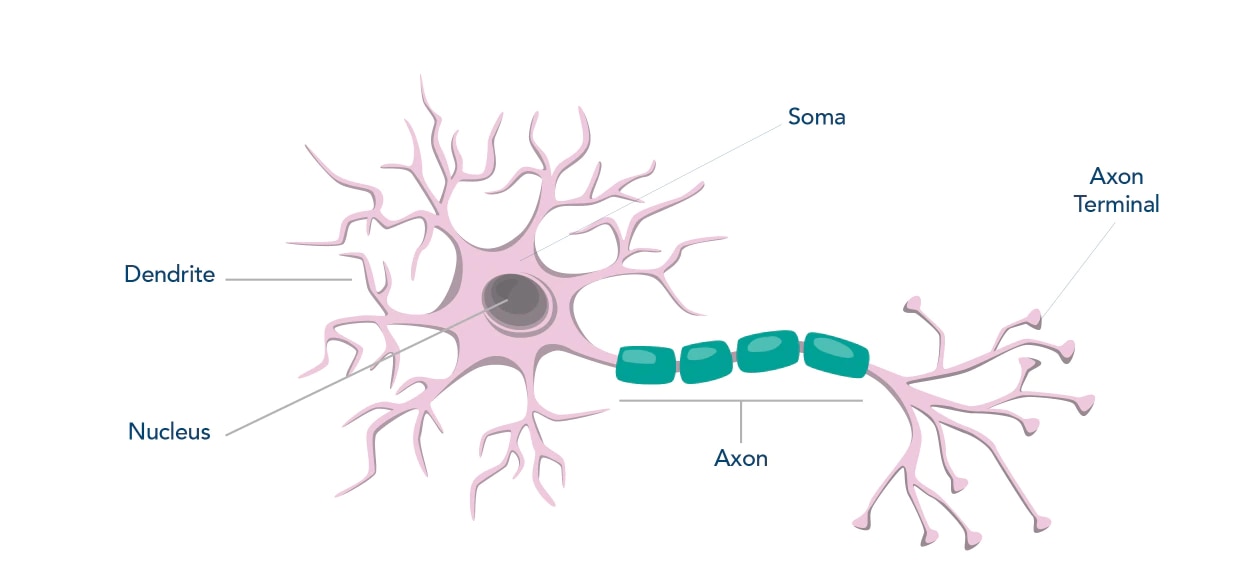
ターゲットタンパク質と細胞局在(神経細胞)
| 核 (Nucleus) |
細胞体 (Soma) |
軸索 (Axon) |
樹状突起 (Dendrite) |
|
| NeuN |
● |
|||
| MAP2 |
● |
● |
||
| Tau |
● |
● |
||
| Beta III Tubulin(TUBB3) |
● |
● |
● |
|
| Enolase 2(NSE、ENO2)
|
● |
|||
| NF-H |
● |
● |
● |
|
| NF-M |
● |
● |
● |
|
| NF-L |
● |
● |
● |
表1. 一般的な成熟神経細胞マーカーの細胞局在