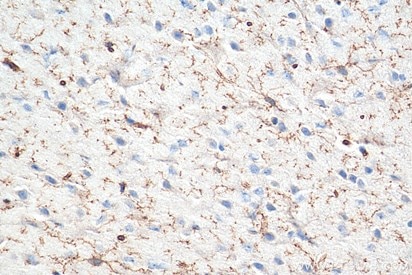
活性型ミクログリア(活性化ミクログリア)の同定方法
プロテインテックの研究者がミクログリア細胞の定量化について解説します。
ミクログリア細胞とは?
ミクログリア細胞は中枢神経系(CNS:central nervous system)に常在する免疫細胞であり、脳の恒常性において重要な役割を果たします。ミクログリア細胞は脳に認められる細胞の10~15%を占めます。その他の中枢神経系細胞とは異なり、ミクログリア細胞は胎生期の卵黄嚢に存在する前駆細胞に由来し、発生初期に中枢神経系へ移動することが明らかになっています。ミクログリア細胞は、発生や疾病におけるその生物学的役割、特殊な成り立ち、腸内細菌叢と情報伝達する可能性等に関して新たな知見が次々と明らかになっており、非常に注目を集める研究対象となっています。
ミクログリア細胞の活性化機構とは?
ミクログリア細胞は非常に運動性の高い細胞で、活性型ミクログリア細胞は明瞭な形態学的変化を示します。中枢神経系の異常を監視する際、ミクログリア細胞は分枝状の形態(Ramified、ラミファイド型)を示し、周辺環境を把握するために突起を伸縮します。ミクログリア細胞は、その他の細胞との双方向性の情報伝達に対する反応として、または病原体、損傷、その他ストレスの存在下で活性型へと変化する刺激を受けます。活性化初期段階では、ミクログリア細胞は突起を伸長し、分枝の複雑性が増した高度に分岐した形態(Hyper-ramified、ハイパー・ラミファイド型)をとります。ハイパー・ラミファイド型は、活性型ミクログリア細胞となる中間段階、または非重篤な刺激に対する軽微な応答状態と考えられます。続く活性化および形態変化の段階で、ミクログリア細胞の突起の退縮と肥厚が生じます(Bushy、ブッシー型)。この期間に、ミクログリア細胞は炎症性サイトカインや抗炎症サイトカイン等の特定の分子を分泌します。最終的に、ミクログリア細胞が完全に活性化すると、アメーバ状の形態(Amoeboid、アメボイド型)をとり、貪食作用に関与するようになります(図1)。
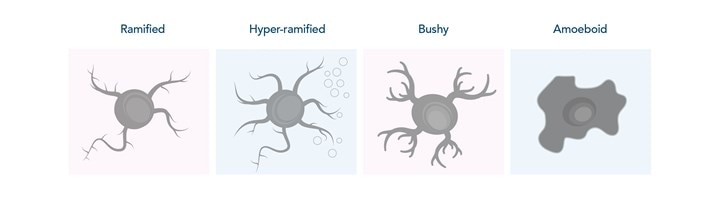
図1. 中枢神経系におけるミクログリア細胞の活性化状態と形態
活性型ミクログリア細胞の同定法
1. 計測
ミクログリア細胞は、活性化すると急速に増殖を開始します。したがって、活性型ミクログリア細胞を特定するかなり大まかな方法として、単純にミクログリア細胞の細胞数を計測し、活性化していない時の細胞数と比較する方法が挙げられます。細胞数を計測する方法を採用する場合は、実験系を無作為化および盲検化して計測するよう留意します。この方法の欠点は、細胞構造や発現タンパク質に関する情報が欠如している点です。
2. 細胞形態解析
ミクログリア細胞はその活性化に基づいて独自の形態を示すため、活性型ミクログリア細胞を検出できる信頼性の高い方法として、細胞構造を数値化する手法が挙げられます。
Sholl解析(ショール解析):活性型ミクログリア細胞を定量化する最も一般的な方法として、Sholl解析による線形化を用いる方法が挙げられます(1)。Sholl解析法では、ミクログリア細胞の放射状分布の解析によって、ミクログリア細胞の分枝数や複雑性を数値化します。この情報を得るためには、円の中心に細胞体が位置するように半径が等距離の同心円をミクログリア細胞に重ねます(図2)。各同心円の円周と突起が交わる交点(intersection)と細胞体からの距離を計測することで、細胞の形態を数値化します。Sholl解析はプログラムソフトによって自動化することが可能で、Image J / ImageJ Fijiではミクログリア細胞のz-stack画像を利用してSholl解析を実施できる拡張機能を使用することができます。
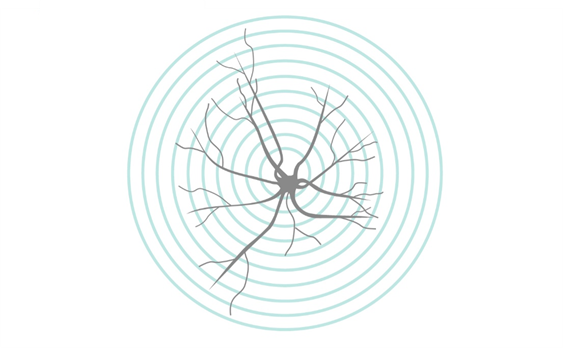
図2. Sholl解析概略図
Skeletal analysis(Skeletal解析):その他の一般的なミクログリア細胞の形態を定量化する方法として、Skeletal解析が挙げられます。この方法では、標識ミクログリア細胞のz-stack画像を取得して二値化し、各細胞の細胞骨格構造をトレースします(図3)。Skeletal解析を自動化できるプログラムが複数利用可能です。例えば、Image J / ImageJ Fijiでは二次元/三次元のSkeltal解析を実施できる拡張機能(Analyze Skeleton 2D/3D)を使用することができ、突起の長さ、分岐末端数(endopoint)、分枝数等のミクログリア細胞に関する詳細な情報が得られます(5)。
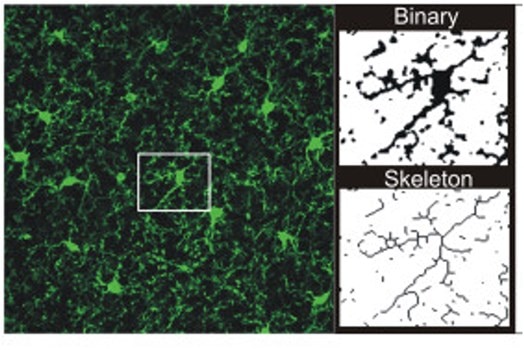
図3. Skeletal解析の一例。画像はMorrison & Filosa (2013)より引用(CC BY2.0)(3)。
3. ミクログリア細胞マーカー
ミクログリア細胞数を計測する、あるいは上述の形態解析を実施するには、細胞をミクログリア細胞に特異的なマーカーで標識する必要があります(2、4)。さらに、ミクログリア細胞特異的マーカーは、ミクログリア細胞を単離するプロトコールの有効性を検証するための鍵となります。ミクログリア細胞は活性型細胞になる際、特定のタンパク質を特異的に発現します。研究者らはミクログリア細胞の重要な活性マーカーを特定することにより、ミクログリア細胞のタンパク質発現の特異的なプロファイルを利用できるようになりました。ミクログリア細胞マーカーは、免疫組織化学(IHC:Immunohistochemistry)、ウェスタンブロット(WB:Western blot)、免疫蛍光染色(IF:Immunofluorescence)、フローサイトメトリー(FC:Flow Cytometry)等の様々なアプリケーションで使用することができます。一般的なミクログリア細胞特異的タンパク質および活性型ミクログリア細胞特異的マーカーの一部を以下に掲載します。プロテインテックが販売するすべてのミクログリアに関連する製品についてはこちらをご覧ください。各マーカー検出用製品の中には、蛍光色素を標識したタイプの製品や、IHC用のキット製品(IHCeasy)等として販売しているものもあります。
P2RY12/P2Y12R
P2RY12/P2Y12Rはアデニル酸シクラーゼ抑制型Gタンパク質(Gi)共役受容体であり、血小板機能、止血、血栓形成等におけるその役割が特に知られています。P2RY12は、血小板の細胞表面に豊富に存在します。中枢神経系では、P2RY12はミクログリア細胞だけに認められ、ミクログリア細胞依存性の神経保護作用に関与します。P2RY12はミクログリア細胞特異的に発現するため、ミクログリア細胞と中枢神経系内の浸潤マクロファージを区別するマーカーとして広く利用されています。プロテインテックのP2RY12ポリクローナル抗体の詳細についてはこちらをご覧ください。
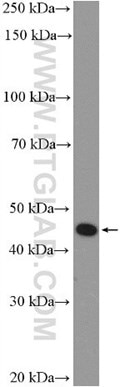
図4. マウス脊髄組織のWB(ウェスタンブロット)解析。サンプルをSDS-PAGE後、P2RY12抗体(カタログ番号:11976-1-AP、希釈倍率1:300)を使用して、室温で1.5時間インキュベーションした。
TMEM119
TMEM119は、骨芽細胞分化への関与が明らかになっているⅠ型膜貫通タンパク質です。中枢神経系では、TMEM119はミクログリア細胞表面にのみ発現し、P2RY12と同様に浸潤マクロファージとミクログリア細胞を区別する信頼性の高いマーカーとなります。TMEM119のミクログリア細胞における正確な生物学的役割は明らかになっていません。プロテインテックのTMEM119に関する製品についてはこちらをご覧ください。
|
|
|
| 図5. TMEM119抗体(カタログ番号:27585-1-AP、希釈倍率1:800)を使用した、パラフィン包埋マウス脳組織スライドの免疫組織化学染色(40倍レンズを使用)。Tris-EDTA buffer(pH9)で熱処理し抗原賦活化した試料を使用。 | 図6. 様々なライセートのWB(ウェスタンブロット)解析。異なる組織ライセートをSDS-PAGE後、TMEM119抗体(カタログ番号:66948-1-Ig、希釈倍率1:20000)を使用して、室温で1.5時間インキュベーションした。 |
TREM2
TREM2はマクロファージ、顆粒球、単球、樹状細胞等の骨髄系細胞に認められる膜貫通受容体です。中枢神経系では、(その他の浸潤性骨髄系細胞が存在しない限り)TREM2はミクログリア細胞にのみ発現します。TREM2はミクログリア細胞の恒常性や、病原体・中枢神経系傷害に対する炎症反応において重要な役割を果たします。プロテインテックのTREM2に関する製品についてはこちらをご覧ください。
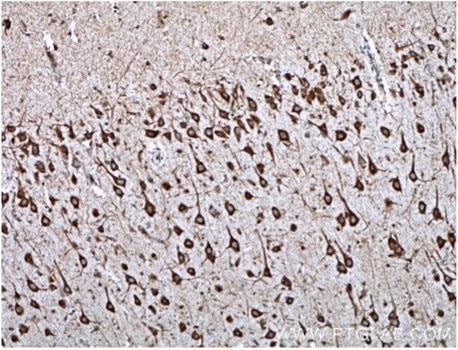
図7. TREM2抗体(カタログ番号:27599-1-AP、希釈倍率1:2000)を使用した、パラフィン包埋ヒト脳組織スライドの免疫組織化学染色(10倍レンズを使用)。Tris-EDTA buffer(pH9)で熱処理し抗原賦活化した試料を使用。
AIF1/Iba1
AIF1/Iba1は細胞質に存在するカルシウム結合タンパク質であり、単球系細胞に発現します。中枢神経系では、AIF1/Iba1はミクログリア細胞に発現しますが、循環マクロファージにも発現し、ミクログリア細胞/マクロファージが活性化すると上方制御(アップレギュレーション)されます。AIF1/Iba1は、平滑筋や内皮細胞の成長や増殖に関与することが認められています。さらに、AIF1/Iba1は活性型ミクログリア細胞の膜運動(膜ラフリング)や貪食作用に携わります。プロテインテックのAIF1/Iba1に関する製品についてはこちらをご覧ください。
 |
 |
|
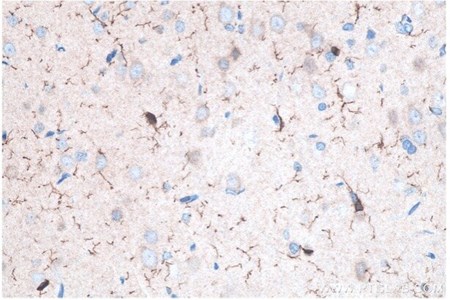
図8. IBA1 IHCキット(IHCeasy)(カタログ番号:KHC0056)を使用した、パラフィン包埋ラット脳組織の免疫組織化学染色。 |
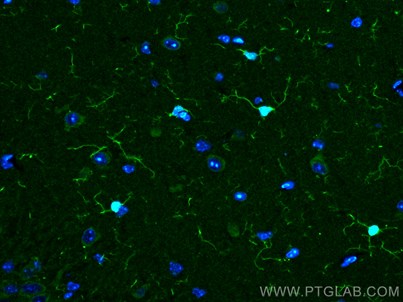
図9. IBA1抗体(カタログ番号:10904-1-AP、希釈倍率1:200)、CoraLite®488標識AffiniPureヤギ抗ウサギIgG(H+L)抗体を使用した、マウス脳組織(4%PFA固定)の免疫蛍光染色解析像。 |
CD11b
CD11bは、単球、顆粒球、マクロファージ、樹状細胞、ナチュラルキラー細胞(NK細胞)等の特定の免疫細胞に発現する接着分子です。中枢神経系では、CD11bはミクログリア細胞に発現し、活性化に伴いその発現は増加します。CD11bは細胞の接着や進展におけるその役割が特に知られています。プロテインテックのCD11bに関する製品についてはこちらをご覧ください。
 |
 |
|
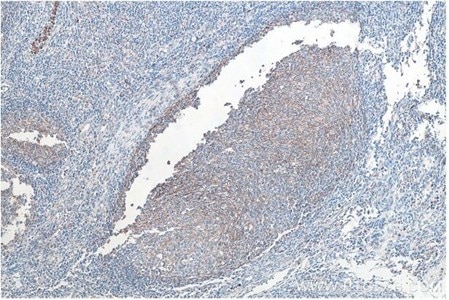
図10. CD11B IHCキット(IHCeasy)(カタログ番号:KHC0027)を使用した、パラフィン包埋ヒト扁桃炎組織の免疫組織化学染色。 |
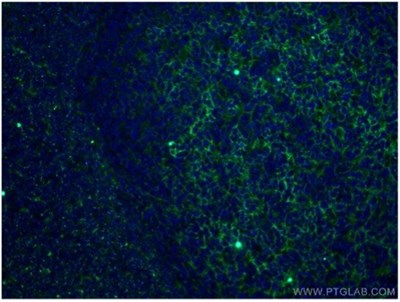
図11. CD11B/Integrin alpha M抗体(カタログ番号:66519-1-Ig、希釈倍率1:100)、CoraLite®488標識AffiniPureヤギ抗マウスIgG(H+L)抗体と使用した、ヒト扁桃炎組織(4%PFA固定)の免疫蛍光染色解析像。 |
CD68
CD68は、マクロファージ、樹状細胞、マスト細胞、好中球、好塩基球等の骨髄系細胞に認められる高度にグリコシル化(糖鎖修飾)されたタンパク質です。中枢神経系では、CD68はミクログリア細胞に発現し、活性化に伴いその発現は増加します。通常、CD68は後期エンドソームに認められ、膜の完全性や抗原プロセシングに関与すると考えられています。CD68は、細胞内の局在や活性化に伴う発現量の変化等の特性から、貪食作用を示すミクログリア細胞を同定する信頼性の高いマーカーとなります。プロテインテックのCD68に関する製品についてはこちらをご覧ください。
 |
 |
|
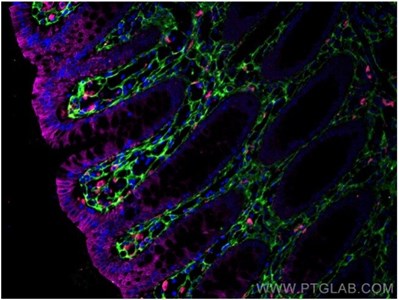
図12. CoraLite®594標識CD68抗体(カタログ番号:CL594-25747、希釈倍率1:200)、Cytokeratin 20抗体(カタログ番号:60183-1-Ig、クローン番号:4D10A4)(緑)、Ⅲ型コラーゲン(N-terminal)抗体(カタログ番号:22734-1-AP)(マゼンタ)を使用したヒト結腸組織(4%PFA固定)の免疫蛍光染色解析像。 |
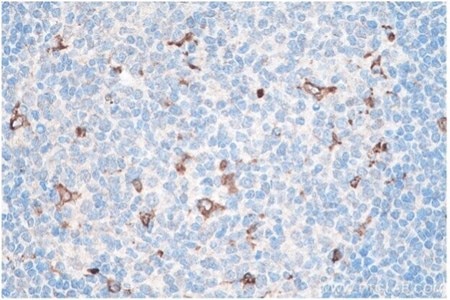
図13. CD68 IHCキット(IHCeasy)(カタログ番号:KHC0006)を使用した、パラフィン包埋ヒト扁桃炎組織スライドの免疫組織化学染色。 |
活性型ミクログリア細胞を同定する最も適した方法は、各々の研究課題により異なります。しかしながら、データの信頼性を証明するには、本稿で取りあげた手法やマーカーを組み合わせて実験を実施することを推奨します。
参考文献
- Cătălin, B., Alexandru, D., Albu, CARMEN., & Iancău, MARIA. (2013). Microglia branching using a Sholl analysis method. Curr Health Sci J, 39(Suppl 4), 1-5.
- Jurga, A. M., Paleczna, M., & Kuter, K. Z. (2020). Overview of general and discriminating markers of differential microglia phenotypes. Frontiers in cellular neuroscience, 14, 198.
- Morrison, H. W., & Filosa, J. A. (2013). A quantitative spatiotemporal analysis of microglia morphology during ischemic stroke and reperfusion. Journal of neuroinflammation, 10(1), 1-20.
- Prinz, M., Masuda, T., Wheeler, M. A., & Quintana, F. J. (2021). Microglia and central nervous system–associated macrophages—from origin to disease modulation. Annual review of immunology, 39, 251-277.
- Young, K., & Morrison, H. (2018). Quantifying microglia morphology from photomicrographs of immunohistochemistry prepared tissue using ImageJ. JoVE (Journal of Visualized Experiments), (136), e57648.