ヒントとコツ | 存在量の少ないタンパク質の免疫沈降(IP)
免疫沈降(IP)で良好な結果を得るには、目的タンパク質の存在量(発現量や濃度)が大きく影響します。存在量が多いタンパク質の場合は、特別に配慮しなくても容易に良好な結果を得られますが、存在量が少ないタンパク質の免疫沈降を行う場合は、プロトコールの最適化が必要になります。
目的タンパク質の存在量は免疫沈降(IP)の重要な要因です。
免疫沈降(IP:Immunoprecipitation)では、アガロースビーズや磁性アガロース等の担体に結合した特異抗体やVHH抗体(別名:Nanobody®)を使用して目的タンパク質(POI:Protein of interest)をプルダウンすることによって回収します。その際、目的タンパク質以外のタンパク質や細胞残渣、脂質等の免疫沈降用ビーズに結合しないサンプル溶液中の物質は、洗浄操作によって除去します。一方、ビーズに結合させてプルダウンした目的タンパク質は、洗浄後に溶出操作を実施して回収します。免疫沈降(IP)で良好な結果を得るには、目的タンパク質の存在量(発現量や濃度)が非常に重要な要因となります。目的タンパク質の存在量が多ければ、免疫沈降(IP)を実施すると大抵の場合は特に問題なく、容易に良好な結果を得ることができます。しかし、目的タンパク質の発現レベルが低く、存在量が少ない場合は、免疫沈降(IP)のプロトコールを最適化しなければならない場合があります。
本稿では、存在量の少ないタンパク質の免疫沈降(IP)を成功させるポイントを紹介します。
目的タンパク質に対する親和性の高い抗体/VHH抗体(別名:Nanobody®)を使用する。
VHH抗体(Nanobody®)は、親和性が高く、解離定数(KD値)の小さい傾向にあるため、免疫沈降に使用すると存在量の少ないタンパク質を効率的にプルダウンすることができます。定常状態の結合方程式によると、KD値に対して目的タンパク質の濃度が等しい場合、目的タンパク質のうち50%がVHH抗体(Nanobody®)と結合していることになります。したがって、より多くの目的タンパク質が抗体と結合し、遊離の目的タンパク質を最小限に抑えるためには、免疫沈降(IP)に用いる抗体またはVHH抗体(Nanobody®)のKD値以上の濃度で目的タンパク質が存在している必要があります。目的タンパク質に対する抗体の親和性が低い場合(すなわち解離定数が高すぎる場合)、目的タンパク質が細胞ライセート中に存在していても、効率的に免疫沈降(IP)でプルダウンすることはできません。その場合、免疫沈降後のSDS-PAGEやウェスタンブロット(WB:Western blot)で確認しても陰性の結果が出てしまいます。
VHH抗体(Nanobody®)は、高い親和性と特異性を示すため、目的タンパク質以外の細胞物質に由来するバックグラウンドを低減します。低いバックグラウンドは、存在量の少ないタンパク質の免疫沈降(IP)を成功させるために必須となる条件の1つです。
クロモテック(2020年よりプロテインテックの一部)のGFP-Trap®は、GFP融合タンパク質を免疫沈降(IP)するための樹脂担体です。GFP-Trap®はアガロースビーズ、磁性アガロースビーズ、磁気ビーズ(Magnetic Particles M-270)、96ウェルプレート等に結合した抗GFP VHH抗体(Nanobody®)で構成されます。GFP-Trap®はKD=1pM(10-12M)の高い親和性で、GFPや一般的なGFPバリアント蛍光タンパク質に結合します。図に示したように、融合タンパク質の存在量が非常に少なく、溶液中濃度が著しく低い場合でも、効率的にプルダウンすることができます。図に示した検証実験では、EGFP(enhanced GFP)を「非常に高い(Very High)」、「高い(High)」、「低い(Low)」、「非常に低い(Very Low)」4種類の濃度に調製し、免疫沈降(IP)を実施してSDS-PAGEとウェスタンブロット(WB)によって解析しました。EGFP濃度が高いサンプル(Very High、High)では、SDS-PAGEにおいてビーズ結合画分(B)のEGFPのバンドが検出できています。EGFP濃度の低いサンプル(Very Low、Low)は、SDS-PAGEではバンドを確認することができませんが、ウェスタンブロット(WB)においてビーズ結合画分(B)のEGFPのバンドを検出できています。また目的タンパク質濃度が非常に高い場合でも、GFP-Trap®は高い免疫沈降(IP)パフォーマンスを発揮するため、ウェスタンブロット(WB)のフロースルー画分(FT)にEGFPのバンドは認められません。
GFP-Trap® Agaroseを使用したEGFPの免疫沈降(IP)
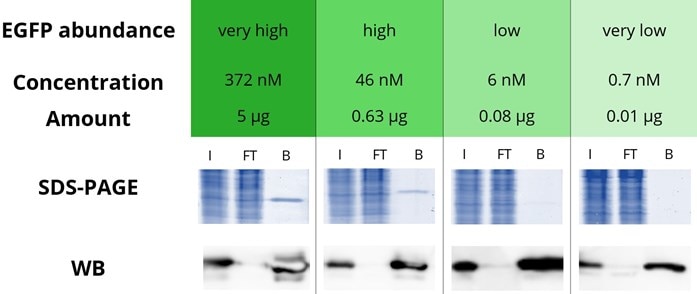
既知濃度のEGFPを異なる4種類の濃度になるよう調製し、HEK293T細胞ライセート500μLに添加しました。免疫沈降(IP)はGFP-Trap®のプロトコールに従って実施し、GFP-Trap®に結合したEGFPは、2xSDSサンプルバッファーで溶出しました。インプット画分(I)、フロースルー画分(FT)、ビーズ結合画分(B)をSDS-PAGEとウェスタンブロット(WB)によって解析しました。SDS-PAGEでは、InstantBlue™を使用してCBB染色を実施しました。WBでは、GFP抗体(カタログ番号:pabg1)と、HRP標識二次抗体を使用してEGFPを染色しました。
*WB解析時、EGFP濃度が高いサンプル(5μg、0.63μg)は、露光時間を短縮して解析を実施しました。
目的タンパク質の濃度を上げる。
目的タンパク質の存在量を増やすことができない場合や、発現量を高めることができない場合は、以下の方法を実施するとアッセイ用サンプル中のタンパク質濃度を上げることができます。
- 使用する細胞数を増やします。1度に採取する細胞数を増やすか、あるいは複数の細胞ペレットを作製し、まとめて細胞ライセートの調製に使用します。
- 細胞ライセートを希釈しないようにします。バッファーを添加しないか、添加する場合は最小限の量にとどめるよう留意します。
注意:細胞ライセート500μLに対してGFP-Trap® 25μL(slurry量)の使用を推奨します。
注意:使用する細胞数を増やすと、場合によっては、洗浄回数を増やすか、より厳しい条件で洗浄する必要があります。
-
2xSDSバッファー20~50μLを使用して溶出操作を行い、SDS-PAGE/WBではできるだけ多くの溶出サンプルをゲルにロードします。
ウェスタンブロット(WB)時、目的タンパク質のシグナルを増幅する。
目的タンパク質の存在量が少ないと、免疫沈降(IP)で目的タンパク質をプルダウンできたとしても、溶出サンプル中の目的タンパク質濃度が低くなり、ウェスタンブロット(WB)で検出するには不十分な場合があります。溶出サンプル中の目的タンパク質濃度が低い場合は、目的タンパク質のウェスタンブロットシグナルの増幅を推奨します。ポリクローナルタイプの一次抗体と二次抗体をウェスタンブロット(WB)に使用すると、最も効果的にシグナルを増幅することができます。

