がんにおけるオートファジーの役割
Dharaniya Sakthivel著(ベイラー医科大学博士課程在籍)
オートファジー(Autophagy)は、自食作用(「Auto:自ら」+「Phagy:食べる」)を意味し、ミスフォールディングタンパク質や損傷したオルガネラ(細胞小器官)等の細胞内物質の分解および再利用に働く細胞内プロセスの1つです。細胞は、物理的ストレス、化学的ストレス、生物学的ストレス等の細胞内恒常性を破綻させる様々な刺激に頻繁に曝されています。そのような環境下において、細胞の完全性を維持するための適応メカニズムとして発達した機構がオートファジーであると考えられています。このオートファジーの機構は、栄養飢餓や病原体感染の状態にある細胞の生存に極めて重要です。また、オートファジーは、細胞増殖、細胞分化、細胞死等の様々な細胞内プロセスを制御します。
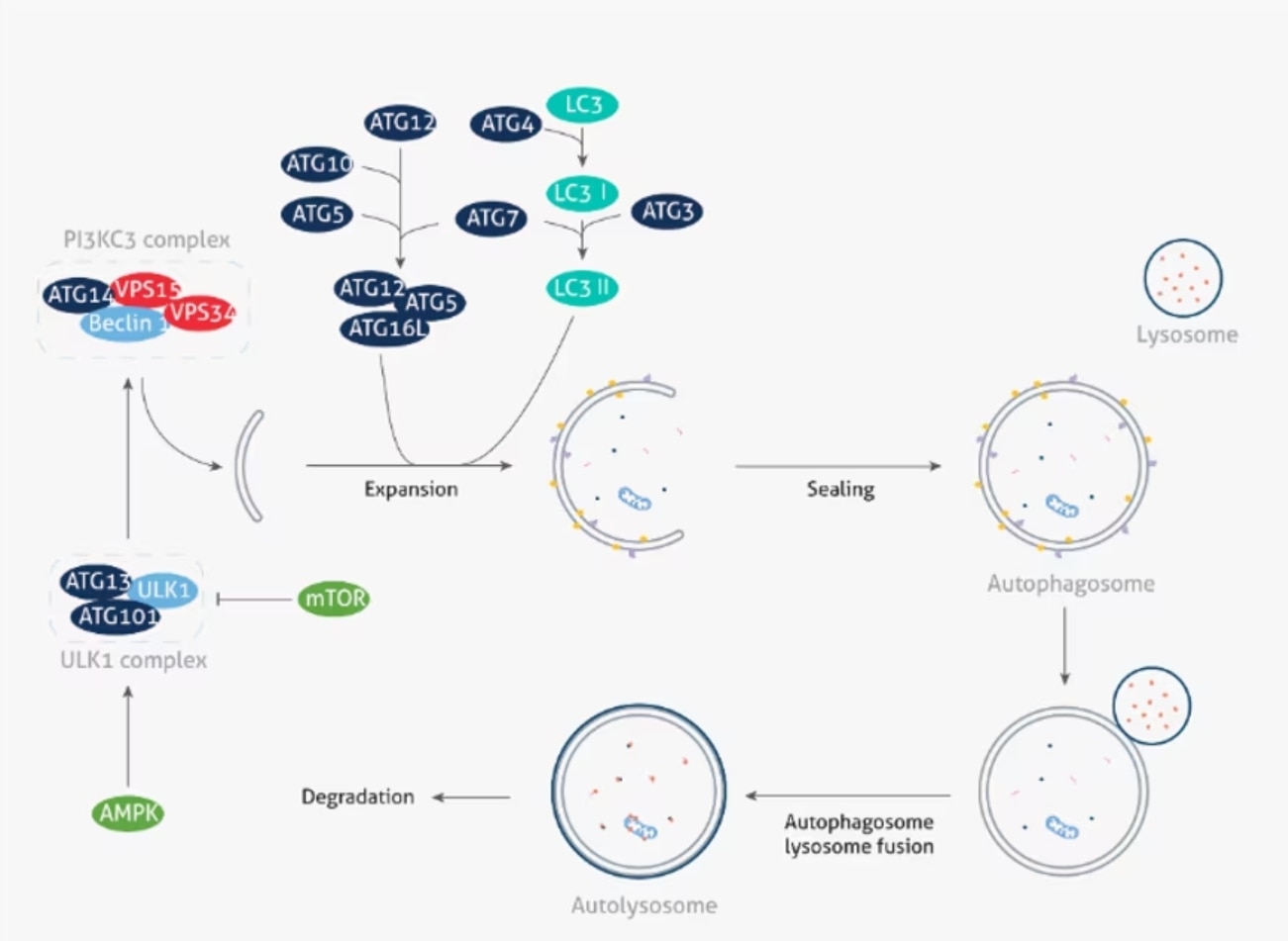
オートファジーは、正常細胞ではATG遺伝子群(Autophagy-related genes、オートファジー関連遺伝子群)によって厳密に制御されます。ATG遺伝子群は、オートファジー機構の非常に重要な特徴である「オートファゴソーム(autophagosome:細胞内成分の一部を隔離して形成される二重膜小胞)」の形成に必須の因子です。オートファゴソームの形成は通常、(1)隔離膜(Phagophore、ファゴフォア)の形成、(2)隔離膜の伸長と閉鎖、(3)成熟(リソソームとの融合)の3段階のプロセスを経て進行します。第1のプロセスでは、栄養源を感知するセンサーであるmTOR(Mammalian target of rapamycin)や細胞内のエネルギーセンサーであるAMPK(AMP-activated protein kinase)が、隔離膜形成の開始で重要な役割を担うULK1複合体の活性化メカニズムに関与します。mTORは、ULK1複合体と相互作用し、抑制的に働く因子です。mTORは、細胞が飢餓状態になると、栄養豊富な環境下では共に複合体を形成していたULK1/2(Unc-51-like kinase 1/2)から解離します。細胞内のエネルギーセンサーであるAMPK(AMP-activated protein kinase)は、ULK1複合体の活性化に働く因子です。AMPKは、栄養飢餓をはじめとする細胞ストレスに応答してULK1複合体を活性化し[1]、隔離膜の形成を誘導します。続くプロセスでは、ATG5-ATG12複合体やLC3(MAP LC3:Microtubule-associated protein 1-light chain 3)が隔離膜と結合し、オートファゴソームの形成が媒介されます。最終段階では、SNARE(Soluble N-ethylmaleimide-sensitive factor attachment protein receptor)分子が、オートファゴソームの成熟を促進します[2, 3]。オートファゴソームは、リソソーム(加水分解酵素を内部に含有する細胞小器官)と融合(「オートリソソーム」の形成)することにより、隔離膜によって取り込んだ内容物を分解し、分解産物は最終的に新たな生体分子の原材料となります。
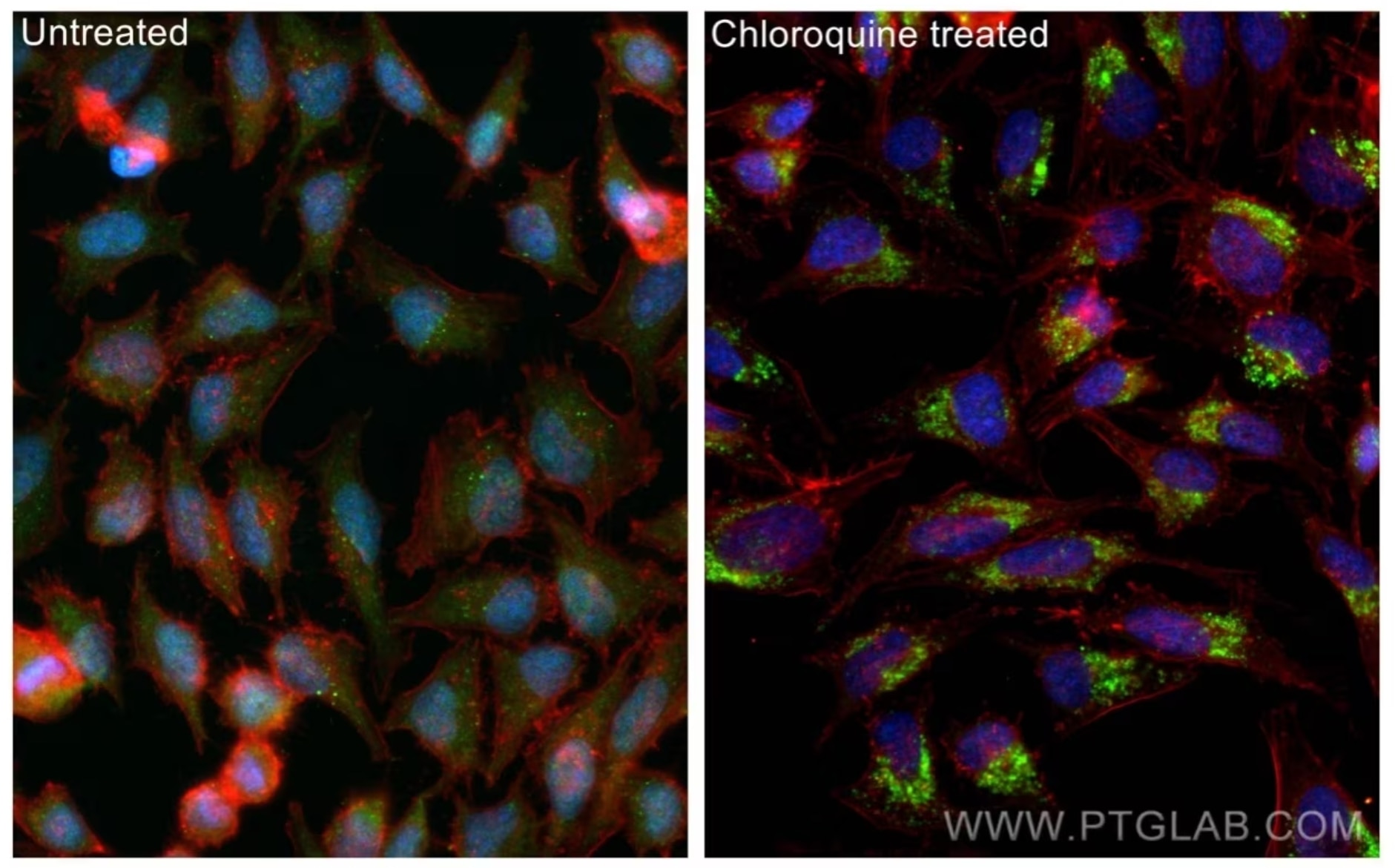
組換えLC3抗体(カタログ番号:81004-1-RR、希釈倍率1:1000)、CoraLite®488標識AffiniPureヤギ抗ウサギIgG(H+L)抗体、CoraLite®594標識βアクチン抗体(赤)を使用した、HeLa細胞の免疫蛍光染色像(左:未処理細胞、右:クロロキン処理細胞)。
プロテインテックの「オートファジー抗体キット(Autophagy Antibody Kit)」は、オートファジー経路で重要な役割を果たす因子やマーカータンパク質を検出する一次抗体が含まれるサンプラーキット(トライアル抗体パック)です。5種類のトライアルサイズ包装の非標識一次抗体が含まれる「オートファジーエッセンシャル抗体キット(Autophagy Essentials Antibody Kit、カタログ番号:PK30004)」は、細胞や組織サンプルにおけるオートファジーの有無を確認するといった初期検討に適したキットです。10種類のトライアルサイズ包装の非標識一次抗体が含まれる「オートファジーエクスパンド抗体キット(Autophagy Expanded Antibody Kit、カタログ番号:PK30005)」は、オートファジー経路の詳細な解析に適したキットです。
腫瘍サプレッサーとしてのオートファジー
オートファジーは、がんにおいて「諸刃の剣」とも称され、二面性を示すことが知られています。すなわち、がんに対して抑制性と促進性のどちらの作用を示すのかは、がんの病期や種類、腫瘍微小環境に大きく依存します。
オートファジーは、機能不全に陥った細胞内の構成物質やタンパク質を除去する能力により、基本的には腫瘍増殖の抑制に働き、腫瘍サプレッサー(抑制因子)として機能します。隔離膜の形成に重要な役割を果たすATG遺伝子の1つであるBeclin 1(BECN1、ATG6)遺伝子は、多くの乳癌、前立腺癌、卵巣癌で欠損していることが報告されています[4]。癌細胞株やマウスモデルでは、Beclin 1遺伝子を導入すると、オートファジー機能の亢進と共に細胞増殖が抑制されることから、Beclin 1は腫瘍サプレッサーの役割を果たす可能性が示唆されています[5]。また、Beclin 1の相互作用タンパク質であるUVRAG(UV radiation resistance-associated gene)やBif-1(Bax-interacting factor-1)等も腫瘍サプレッサーとして機能する可能性があります[6]。
マウスでは、オートファジーの中心的な役割を果たすタンパク質であるATG5やATG7等の欠失によって、オートファジー機能を欠損した細胞が生じ、肝臓がんを発症することが示されています。その際、腫瘍の増殖には酸化ストレスの蓄積が関連することが示唆されています[7]。また、ATG4ノックアウトマウスでは、発がん性物質への暴露後に線維肉腫を発症しやすくなることが報告されています。
オートファジーは、活性酸素種(ROS:reactive oxygen species)の増加によっても誘導されることが知られています[8]。活性酸素種(ROS)の増加は、酸化還元バランスを崩壊させ、炎症誘発性シグナル伝達カスケードの活性化、細胞増殖の増進、DNA損傷やゲノムの不安定化を招くことで、腫瘍の発生や増殖に寄与します。オートファジーの誘導は損傷ミトコンドリアの分解や除去に寄与するため、腫瘍の発生を防ぐ可能性があります。このような知見を総合すると、オートファジーはがん化や腫瘍の抑制に働く極めて重要なメカニズムと言えます。
 |
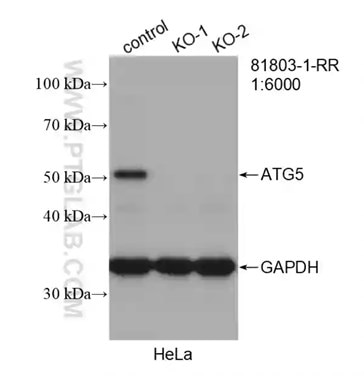 |
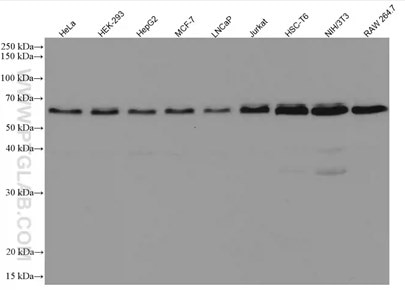
| Beclin 1モノクローナル抗体(カタログ番号:66665-1-Ig)を使用した様々な細胞ライセートのウェスタンブロット。 | ATG5組換え抗体(カタログ番号:81803-1-RR)を使用したHeLa細胞のウェスタンブロット(control:野生型細胞、KO:ATG5ノックアウト細胞)。 |
腫瘍プロモーターとしてのオートファジー
オートファジーは腫瘍サプレッサーとして作用する一方、進行がんにおける腫瘍増殖を促進する腫瘍プロモーター(促進因子)として作用する可能性があります。オートファジーは、常に栄養と酸素の欠乏状態にある、固形癌の中心領域で活性化されます[9]。腫瘍細胞は、オートファジーにより得られる細胞内のリサイクル物質由来の代謝産物を得ることで、継続的に細胞増殖するための高いエネルギー要求を満たすと考えられます。
低酸素誘導因子のHIF-1α(Hypoxia-inducible factor-1 alpha)は、細胞が低酸素状態に適応する際に発現する転写因子です。HIF-1αを介したオートファジーの誘導も報告されており、迅速な細胞生存応答に働きます。また、極度の低酸素環境下ではHIF-1α非依存的なオートファジー誘導のプロセスも知られています。その際、AMPKがmTORを阻害する機構や、低酸素状態・グルコース飢餓等に対するストレス応答の一種であるUnfolded protein response(UPR、小胞体ストレス応答)によるシグナル伝達機構が関与すると考えられています[10]。さらに、活性化されたオートファジー経路は、間接的にHIF-1αの嫌気的解糖系に対する作用に影響を与え、グルコース産生や取り込みの促進を媒介します[11, 12]。以上のように、低酸素環境で誘導されるオートファジーは、ストレス耐性の増強と栄養源の供給に役割を果たし、抗がん剤等の効果を妨げることや腫瘍の維持・生存に寄与する可能性が示唆されます。
Rasタンパク質(Rat sarcoma virus protein)形質転換細胞を用いた実験では、オートファジー機能を欠損させた場合に異常なミトコンドリアが蓄積すると共に細胞生存率が低下することから、機能的なミトコンドリアがRasタンパク質形質転換細胞の生存と維持には必要であることが示されています[13]。つまり、オートファジーは、細胞内の栄養が不足している場合に正常なミトコンドリア機能の維持に必要とされることが示唆されます。Ras変異細胞は、肺がん、結腸がん、膵臓がんの発症に関連しており、オートファジーのレベルが高いことが観察されます。
がん細胞は、血流を介した別の臓器への転移能、遊走能、侵襲能、コロニー形成能を生来の性質として備えています。がん細胞が新たに転移するには、細胞外マトリックス(ECM:Extracellular matrix)非存在下で増殖しなければなりません。がん細胞が原発部位から遊離した場合、細胞外マトリックス(ECM)の喪失により「アノイキス(Anoikis)」と呼ばれる細胞死が誘導されます。オートファジーは、アノイキスに対する耐性を付与するため、細胞外マトリックス(ECM)から脱離したがん細胞の増殖と関連付けられています[14]。実際に、オートファジーの阻害は、アノイキスに対する耐性を最小限に抑制し、肝細胞癌の肺転移を抑えることが報告されています[15]。
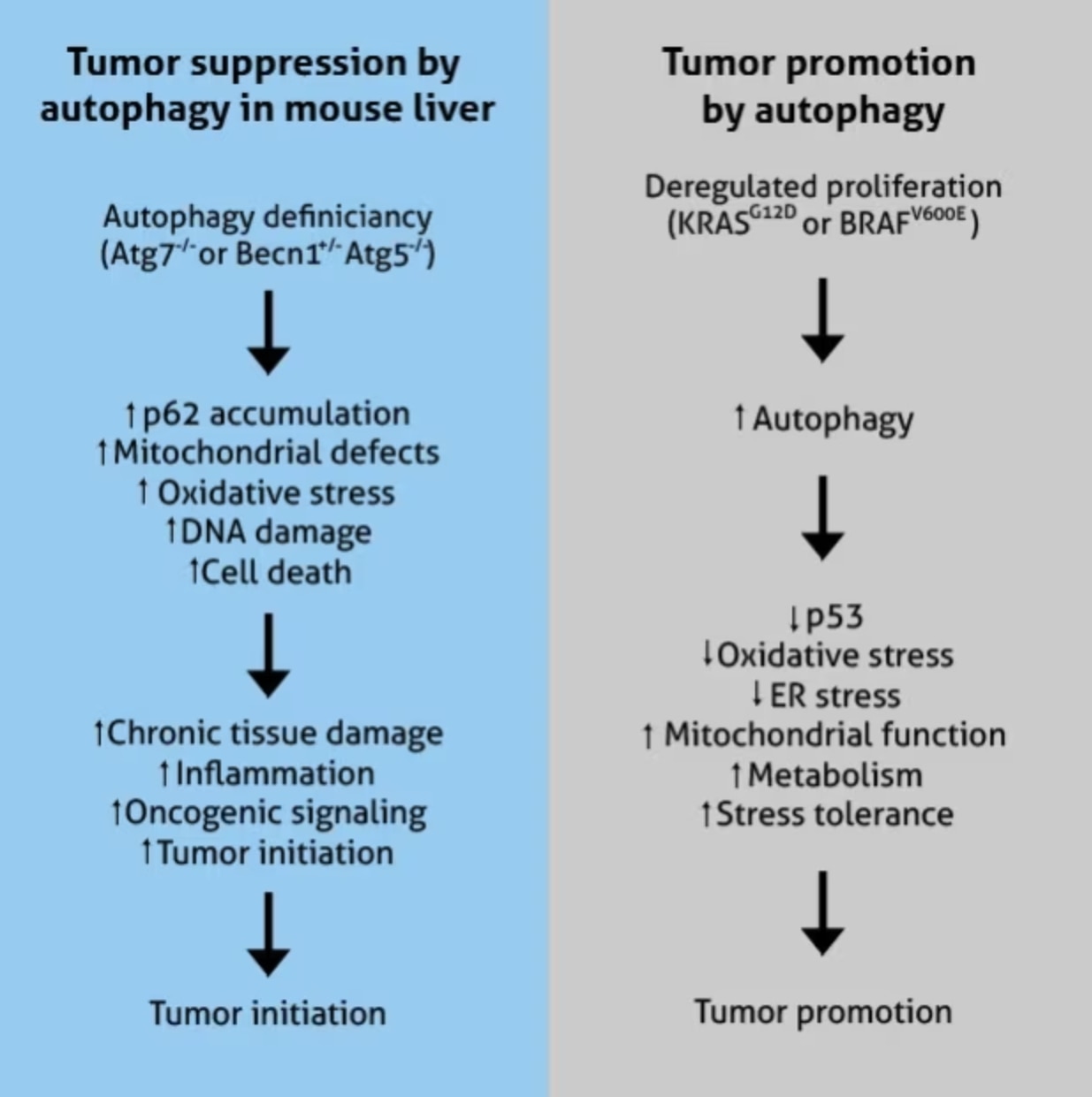
がんにおけるオートファジーの予想される腫瘍サプレッサー・腫瘍プロモーターとしての役割(図はE White, 2015より引用。PMID:25654549[18])
治療上の意義
近年、大きな関心を集めている研究対象の1つとして、オートファジー阻害剤やクロロキン(CQ:Chloroquine)あるいはヒドロキシクロロキン(HCQ:Hydroxychloroquine)等のオートリソソーム形成阻害剤のがんに対する作用の研究が挙げられます。クロロキン(CQ)やヒドロキシクロロキン(HCQ)を従来の化学療法に用いられる薬剤と併用すると、がん細胞が種々の薬剤に対して感受性を示すようになり、治療効果が増強されることが報告されています。クロロキン(CQ)やヒドロキシクロロキン(HCQ)は、オートファジーフラックスを阻害する作用がある一方、がんにおけるTLR9(Toll-like receptor 9)、p53、CXCR4-CXCL12経路等の調節経路に対する阻害作用や活性化作用を有します[16]。様々な因子に影響を及ぼすことから、これらの薬剤の効果や特異性は注意深く検討される必要があります。これまでにオートファジーをターゲットとする研究によって、初期段階のオートファゴソーム形成に関与するVps34阻害薬(Vps34:クラスⅢ PI3K、class ⅢPhosphatidylinositol-3 kinase)やULK1阻害剤(ULK:UNC-51-like kinase)等の候補薬剤が開発されています[17]。
概して、がんにおけるオートファジーの役割は複雑かつ多面的です。オートファジーががんに影響を及ぼすメカニズムの解明は、現在も活発な研究領域の1つであり、腫瘍微小環境をターゲットにした新たな治療薬を開発するうえで重要な鍵になると考えられます。
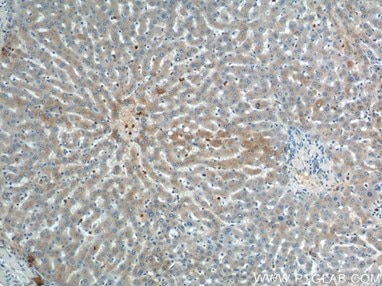 |
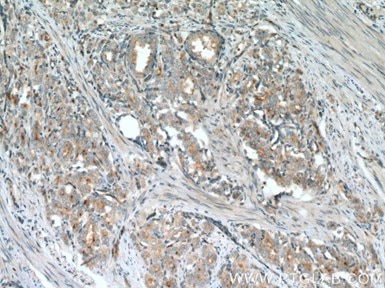 |
| ポリクローナルULK1抗体(カタログ番号:20986-1-AP、希釈倍率1:200)を使用したヒト肝臓組織の免疫組織化学染色。 | ポリクローナルVPS34(C terminal)抗体(カタログ番号:12452-1-AP、1:200)を使用したヒト前立腺がん組織の免疫組織化学染色。 |
参考文献
- D F Egan, R J Shaw, et al. Phosphorylation of ULK1 (hATG1) by AMP-activated protein kinase connects energy sensing to mitophagy. Science. 2011 Jan 28;331(6016):456-61.
- J Romanov, M Walczak, S Martens, et al. Mechanism and functions of membrane binding by the Atg5-Atg12/Atg16 complex during autophagosome formation. EMBO J. 2012 Nov 14;31(22):4304-17.
- C M Fader, D G Sánchez, M I Colombo, et al. TI-VAMP/VAMP7 and VAMP3/cellubrevin: two v-SNARE proteins involved in specific steps of the autophagy/multivesicular body pathways. Biochim Biophys Acta. 2009 Dec;1793(12):1901-16.
- X Qu, et al. Promotion of tumorigenesis by heterozygous disruption of the beclin 1 autophagy gene. J Clin Invest. 2003 Dec;112(12):1809-20.
- X H Liang, B Levine, et al. Induction of autophagy and inhibition of tumorigenesis by beclin 1. Nature. 1999 Dec 9;402(6762):672-6.
- E Morselli, L Galluzzi, G Kroemer, et al. Anti- and pro-tumor functions of autophagy. Biochim Biophys Acta. 2009 Sep;1793(9):1524-32.
- A Takamura, M Komatsu, N Mizushima, et al. Autophagy-deficient mice develop multiple liver tumors. Genes Dev. 2011 Apr 15;25(8):795-800.
- J N Moloney, T G Cotter. ROS signalling in the biology of cancer. Semin Cell Dev Biol. 2018 Aug:80:50-64.
- J D Rabinowitz, E White. Autophagy and metabolism. Science. 2010 Dec 3;330(6009):1344-8.
- N M Mazure, J Pouysségur. Hypoxia-induced autophagy: cell death or cell survival? Curr Opin Cell Biol. 2010 Apr;22(2):177-80.
- I Sinha, D Sakthivel, A J Wagers, et al. Prolyl Hydroxylase Domain-2 Inhibition Improves Skeletal Muscle Regeneration in a Male Murine Model of Obesity. Front Endocrinol (Lausanne). 2017 Jul 5:8:153.
- G N Masoud, W Li. HIF-1α pathway: role, regulation and intervention for cancer therapy. Acta Pharm Sin B. 2015 Sep;5(5):378-89.
- J Y Guo, H-Y Chen, R Mathew, J Fan, E White, et al. Activated Ras requires autophagy to maintain oxidative metabolism and tumorigenesis. Genes Dev. 2011 Mar 1;25(5):460-70.
- M C Guadamillas, A Cerezo, M A del Pozo. Overcoming anoikis--pathways to anchorage-independent growth in cancer. J Cell Sci. 2011 Oct 1;124(Pt 19):3189-97.
- Y-F Peng, J Fan, et al. Autophagy inhibition suppresses pulmonary metastasis of HCC in mice via impairing anoikis resistance and colonization of HCC cells. Autophagy. 2013 Dec;9(12):2056-68.
- C Verbaanderd, G Bouche, et al. Repurposing Drugs in Oncology (ReDO)-chloroquine and hydroxychloroquine as anti-cancer agents. Ecancermedicalscience. 2017 Nov 23:11:781.
- R K Amaravadi, et al. Targeting Autophagy in Cancer: Recent Advances and Future Directions. Cancer Discov. 2019 Sep;9(9):1167-1181.
- E White. The role for autophagy in cancer. J Clin Invest. 2015 Jan;125(1):42-6.

