Myc-Trap®を用いたMycタグ融合タンパク質の免疫沈降(IP)およびアフィニティ精製
Mycタグ融合タンパク質のプルダウン/免疫沈降(IP)実験にMyc-Trap®を使用する場合の利点と留意点について解説します。
はじめに
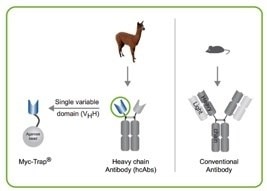
クロモテック(2020年よりプロテインテックの一部)のMyc-Trap®は、VHH抗体(別名:Nanobody®)と呼ばれるアルパカの単一ドメイン抗体に由来する、Mycタグ配列を認識して結合する抗MycタグVHH抗体で構成されるアフィニティ樹脂です。Myc-Trap®は、抗MycタグVHH抗体がアガロースビーズまたは磁性アガロースビーズに結合したフォーマットとして提供されます。Myc-Trap®を免疫沈降(IP:Immunoprecipitation)やアフィニティ精製の実験に適用する場合、従来型のIgG抗体を使用する場合よりも多くの利点を提供します。
- 目的のタンパク質に重鎖や軽鎖によるコンタミネーションが生じません(従来型抗体が結合したアフィニティ樹脂を使用すると、精製タンパク質に抗体由来の重鎖や軽鎖が混入する場合があります)。
- Mycタグ融合タンパク質に対して高い特異性・感度・親和性で結合するため、発現量や存在量の少ないMycタグ融合タンパク質であっても、高い効率と再現性でプルダウンまたは精製を実施することが可能です。
- Mycタグペプチドを用いて効率的かつ穏やかな溶出条件を適用できるため、ネイティブな状態の目的タンパク質を回収できます。
実験パフォーマンスの調整と最適化
Myc-Trap®の発揮する性能は、Mycタグ融合タンパク質の免疫沈降(IP)やアフィニティ精製実験に最適化されています。Mycタグ融合タンパク質は、単一のMycタグ、すなわち1xMyc(アミノ酸配列:EQKLISEEDL)を使用するか、繰り返し配列のMycタグ、すなわち2xMyc(アミノ酸配列:EQKLISEEDLEQKLISEEDL)を使用するかによって異なる親和性/結合特性を示します。Myc-Trap®は、あらゆるMycタグ融合コンストラクトに対して適用でき、免疫沈降(IP)、共免疫沈降(Co-IP)、タンパク質精製用途に使用できます。その際、タグ融合タンパク質の発現量や下流のアプリケーションに応じて1xMycタグ融合タンパク質または2xMycタグ融合タンパク質のいずれかを戦略的に選択できます。表1にその概要を示します。
|
1xMycタグ融合タンパク質: |
2xMycタグ融合タンパク質: |
|
|
表1. 概要:免疫沈降(IP)、アフィニティ精製用樹脂であるMyc-Trap®は、1xMycタグ融合タンパク質と2xMycタグ融合タンパク質を使い分けることで、下流のアプリケーション等に応じて結合パフォーマンスを調整することができます。注:Myc-Trap®は、免疫沈降(IP)、共免疫沈降(Co-IP)およびアフィニティ精製のいずれの場合でも、あらゆるMycタグ融合コンストラクトに使用できます。
Mycタグ融合タンパク質の結合効率や溶出方法に影響するMyc-Trap®の特性について
クロモテックはMyc-Trap®の機能を明らかにするために、Mycタグに対するMyc-Trap®の結合特性を検証しました。その結果、1xMycタグ融合タンパク質よりも2xMycタグ融合タンパク質の方がMyc-Trap®に対して強固に結合することが判明しました。このことは両者の解離定数(KD)が異なることを示したデータからも明らかです。解離定数の違いは、2種類のMycタグペプチドそれぞれに対して、Myc-Trap®が認識するエピトープと結合様式の差に起因します。Myc-Trap®のエピトープに関する概要および考察はホワイトペーパー「How to plan an immunoprecipitation of your Myc-tagged protein using the ChromoTek Myc-Trap[PDF](言語:英語)」をご覧ください。
表2には、1xMycタグ融合MBPタンパク質(1xMyc-MBP、MBP:Maltose Binding Protein)と2xMycタグ融合MBPタンパク質(2xMyc-MBP)の反応速度論パラメーターを記載しました。Myc-Trap®は1xMycタグ融合タンパク質に対してKD=400 nMと低い解離定数を示し、強固な結合特性が明らかとなりました。1xMycタグ融合タンパク質のKDの値だけを見ても、免疫沈降(IP)を実施するにあたって一般的に必要となる解離定数の要件に適合します。一方で、2xMycタグ融合タンパク質を用いた場合、Myc-Trap®は驚くべきことにKD=0.5 nMという極めて低い値を示しました。この値は、1xMycタグ融合タンパク質に対する解離定数の1000分の1程度であり、より強固にMyc-Trap®と結合することが判明しました。両者の反応速度論の数値は、Myc-Trap®を使用した際の2xMycタグ融合タンパク質の高いプルダウン収率と結合効率の根拠となります。また、1xMycタグ融合タンパク質を穏やかな条件で溶出できる特性を説明します。
1xMycタグ融合タンパク質と2xMycタグ融合タンパク質は、アフィニティ樹脂であるMyc-Trap®に対して高い結合速度定数(kon)の値を示し、迅速に結合することが分かります。そのため、Mycタグ融合タンパク質は30分以内にMyc-Trap®にほぼ結合した状態となり、一般的な免疫沈降(IP)実験よりも結合ステップに要するインキュベーション時間を短縮することができます。また、2xMycタグ融合タンパク質を利用した場合、解離速度定数(koff)の値が低いため、結合後の各バッファー中でのインキュベーション時間や洗浄時間を延長することができます。一方、解離速度定数(koff)の値が比較的高い1xMycタグ融合タンパク質の場合、短時間の間に即時洗浄操作を実施する必要があります。
|
反応速度論パラメーター |
1xMycタグ融合MBPタンパク質 |
2xMycタグ融合MBPタンパク質 |
|
解離定数(KD) |
400 nM |
0.5 nM |
|
結合速度定数(kon) |
5.3 x 105 M-1 s-1 |
2.9 x 105 M-1 s-1 |
|
解離速度定数(koff) |
2.1 x 10-1 s-1 |
1.4 x 10-4 s-1 |
表2. 1xMycタグ融合タンパク質と2xMycタグ融合タンパク質の反応速度論パラメーター
実験には1xMycタグまたは2xMycタグを融合したMBPタンパク質を使用しました。1xMyc-MBPタンパク質のKDの値はアフィニティ樹脂と強く結合することを示しており、一般的な免疫沈降(IP)実験に求められる値の範囲内にあります。そのため、1xMycタグ融合タンパク質を穏やかな条件で効率的に溶出させることができます。2xMyc-MBPタンパク質のKD値は1xMyc-MBPタンパク質のKD値の1000分の1程度であり、著しく高い親和性と増強した結合強度を示し、Myc-Trap®の極めて優れた免疫沈降(IP)パフォーマンスを実証しています。2xMycタグとMyc-Trap®の親和性の高さは、2xMycタグ融合タンパク質が低濃度である場合や、厳しい結合条件下で実験する場合でも、2xMycタグ融合タンパク質との結合を実現します。
免疫沈降(IP)実験では、実験目的や下流のアプリケーション等によって、様々な溶出方法が選択肢として存在します。穏やかな条件の溶出方法が求められるのか、あるいは効率的にプルダウン/結合させることを優先する必要があるのかといった実験計画に依存して、溶出方法を選択します。表3には、4種類の溶出オプションとその溶出効率を示しました。表3に示す通り、Myc-Trap®を用いた場合の一連の溶出方法の効率性は免疫沈降(IP)/アフィニティ精製に1xMycタグ融合タンパク質と2xMycタグ融合タンパク質のどちらを利用するかによって異なります。
- 目的タンパク質をネイティブな状態で効率的かつ穏やかな溶出条件で回収したい場合は、1xMycタグ融合タンパク質を使用します。
- 発現量/存在量が少ない、あるいは低濃度のMycタグ融合タンパク質を効率的にプルダウン・結合させたい場合は、実験に2xMycタグ融合タンパク質を使用します。
|
溶出バッファー/添加剤 |
溶出効率 |
|
|
1xMycタグ融合MBPタンパク質 |
2xMycタグ融合MBPタンパク質 |
|
|
+++ |
+ |
|
|
尿素(8 M) |
+++ |
+ |
|
グリシン(0.2 M)pH 2.5 |
+ |
+ |
表3. Myc-Trap®使用時の溶出オプションの効率性
実験には1xMycタグ融合MBPタンパク質(1xMyc-MBP)と2xMycタグ融合MBPタンパク質(2xMyc-MBP)を使用しました。2xMycタグの代わりに3xMycタグを使用することも可能です。
+:約50%、++:約70%、+++:約90%(結合タンパク質の回収率)
今回明らかとなった上記データを実験開始前に参照することで、Myc-Trap®を使用する実験の最適な条件を検討することができます。Myc-Trap®を用いる実験系において1xMycタグと2xMycタグのどちらを使用すべきかを検討する際には、表4にまとめた内容を参照してください。
|
1xMycタグ融合タンパク質 |
2xMycタグ融合タンパク質 |
|
|
表4. 実験計画時の検討事項に関する概要
Myc-Trap®の親和性や溶出条件、あるいはMyc-Trap®のエピトープに関する情報や1xMycタグおよび2xMycタグの結合様式に関する詳細情報は、プロテインテックのホワイトペーパー「How to plan an immunoprecipitation of your Myc-tagged protein using the ChromoTek Myc-Trap(言語:英語)」をご覧ください。

