存在量の少ないタンパク質のウェスタンブロット(WB)検出
存在量の少ないタンパク質の検出は簡単ではありません。本稿ではウェスタンブロットを最適化する方法について解説します。
高感度なウェスタンブロットが求められる理由とは?
ウェスタンブロット(WB:Western blot)は、サンプル中の特定のタンパク質の発現や存在量を調べるために用いられる非常に重要な実験手法です。ウェスタンブロット実験で得られるデータは、研究対象に関する多くの情報を提供するため、多岐にわたる研究において有力な手法として使用されています。一方で、ウェスタンブロット解析で存在量が少ない(発現量や濃度が低い)微量なタンパク質を検出することは簡単ではありません。通常の方法で検出できない場合、微量なタンパク質をウェスタンブロットで観察するための複数の最適化ステップが存在します。
存在量の少ないタンパク質を検出する必要に迫られる背景には、様々な理由があります。例えば、タンパク質の中には発現量が低いというだけでなく、タンパク質の局在が原因となって抽出が困難なために容易に検出できないタンパク質があります。またウェスタンブロットアッセイの特性上、濃度の低いタンパク質を用いる場合、必然的に総タンパク質量は少なくなります。さらに貴重な組織サンプルを使用するケースのように、得られるサンプル量自体に制約がある場合も多くあります。このようなアッセイ上の特性とサンプル調製の制約に加えて、研究では複数回のアッセイを試行する必要があることを考慮すると、ウェスタンブロット実験に利用できるサンプル量が頻繁に制限されることを意味します。本稿では、サンプル中の微量タンパク質を検出するための複数のウェスタンブロット最適化法を解説します。
より高感度な検出法を検討する
ウェスタンブロットの検出手法には様々な種類があり、それぞれに長所と短所が存在します。最も一般的なウェスタンブロット検出法の1つは、酵素であるHRP(Horseradish peroxidase、西洋ワサビペルオキシダーゼ)を標識した抗体を使用する方法です。HRPはルミノール基質と過酸化水素の反応を触媒し、ルミノール基質は酸化される際に化学発光シグナルを生じます。その他の検出法としては、蛍光試薬を標識した抗体を使用する方法もよく用いられます。蛍光色素標識抗体はマルチプレックス(多重化)染色を簡便かつ容易にします。しかし、蛍光検出系は化学発光検出系と比較して感度が低いという欠点が挙げられるため、存在量の少ないタンパク質を検出する場合はHRPと化学発光試薬を使用する方法を強く推奨します。
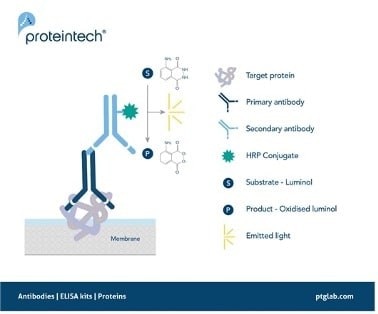
図1. 化学発光WBにおけるシグナルの発生原理。
HRP標識二次抗体は、HRPの基質であるルミノールを酸化させる際に副産物として生じる発光を利用して、目的タンパク質を検出します。
シグナル増強のための改良された化学発光基質を利用する
存在量の少ないタンパク質の場合、検出シグナルが微弱でシグナルノイズ比(S/N比)が小さくなるため、通常の化学発光検出系を採用しても検出には困難を伴います。最も効率的に検出感度を増強できる方法は、改良された高感度な化学発光基質を用いる方法です。高感度な化学発光基質は、通常の化学発光基質と比較して、より増強された化学発光シグナルを産生するように改良されています。より強く発光する基質を使用すれば、存在量の少ないタンパク質を可視化できる可能性が高くなります。
プロテインテックは、fg(フェムトグラム)レベルのタンパク質を検出できる高感度化学発光基質「SignalBright(シグナルブライト)」の販売を開始しました。SignalBrightを使用すると、超高感度検出によって優れたS/N比を得られることから、十分なシグナル強度を得られる可能性が高くなり、少量サンプル中や発現量の低い目的タンパク質の可視化を可能にします。SignalBrightシリーズは、感度の異なる3種類のSignalBright基質、SignalBright Pro(プロ)(カタログ番号:PK10011)、SignalBright Plus(プラス)(カタログ番号:PK10012)、SignalBright Max(マックス)(カタログ番号:PK10013)を販売しています。3通りの異なる感度のECL基質があることから、どのような実験条件であっても適した感度の製品を選択することができます。以下の表にはSignalBrightシリーズの各概要と、パフォーマンスに関する重要な特性をまとめています。
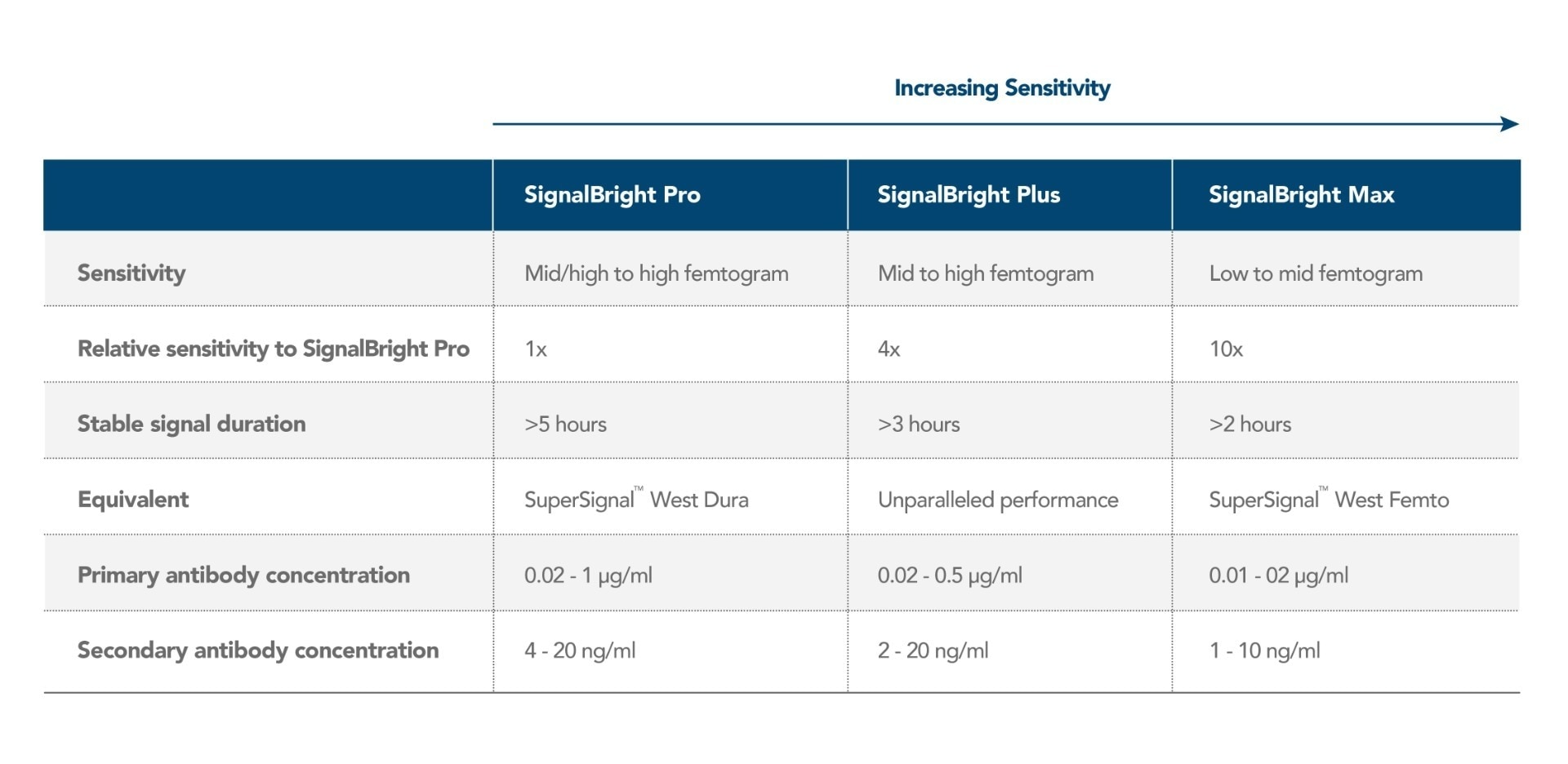
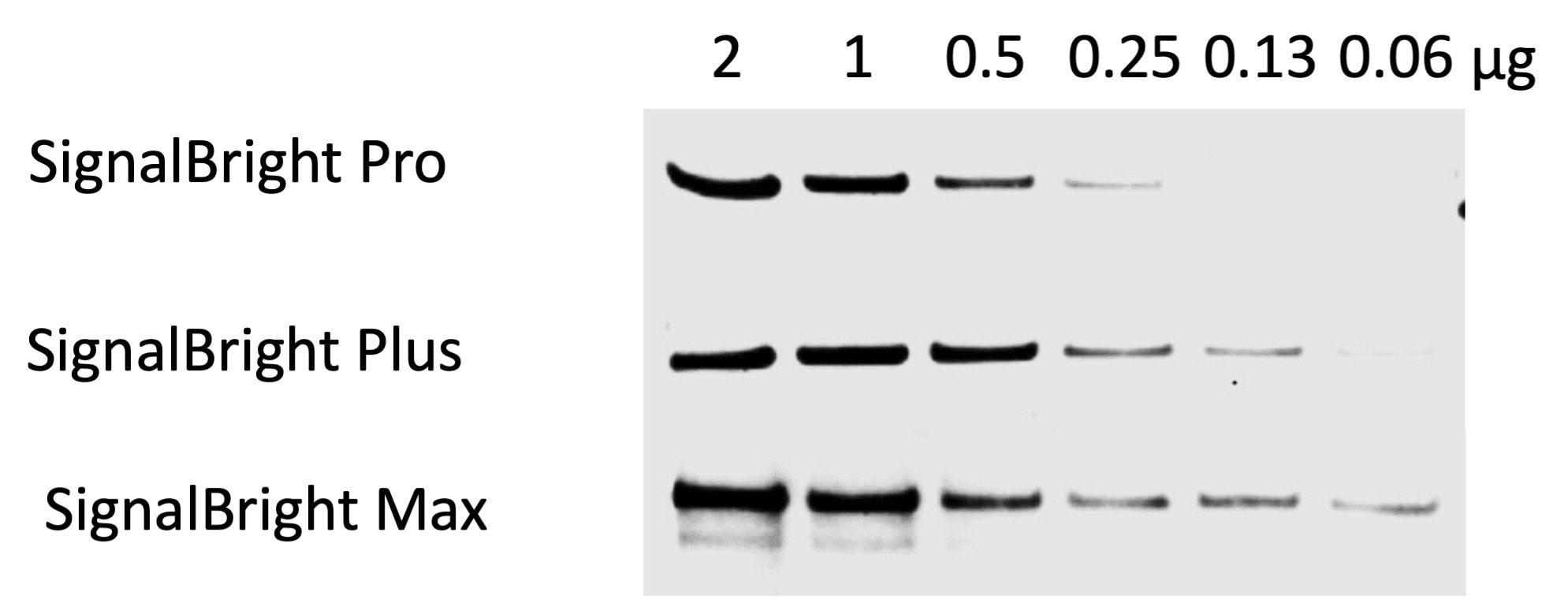
図2. SignalBright Pro(カタログ番号:PK10011)、SignalBright Plus(カタログ番号:PK10012)、SignalBright Max(カタログ番号:PK10013)のシグナル比較(段階希釈したHeLa細胞ライセートを使用)。一次抗体:β-catenin(カタログ番号:51067-2-AP、希釈倍率1:20,000)、二次抗体:HRP標識ヤギ抗ウサギIgG(H&L)抗体(Quanta BioDesign社、品番:11-0201-0503、希釈倍率1:100,000)、露光時間:30秒。
SignalBrightシリーズは、明るい安定したシグナルを最大5時間以上生成します。したがって、SignalBright基質により得られる長時間安定したシグナルによって、試薬を反応させてシグナルを発生させた直後にイメージングを実施する必要がなくなります。撮影可能な時間が延長し、必要に応じて繰り返しイメージングを行うことが可能になることで、余裕を持って実験に取り組めます。
効率的な抽出方法と転写(トランスファー)の検討について
目的タンパク質(POI:Protein of interest)の効率的な抽出方法の検討は、一連のウェスタンブロットプロトコールの確立時に実施する最初のステップの1つです。例えば、転写因子やヒストン修飾酵素等のタンパク質は通常は核内に存在するため、その局在が原因となって抽出が困難となる場合があります。核に局在するタンパク質の場合、細胞膜を溶解するだけでなく核膜を溶解して目的タンパク質を効率的にライセート中に溶出できるか否かが、ウェスタンブロットの結果に大きく影響を及ぼします。同様に、ミトコンドリア等のその他の細胞内小器官に局在するタンパク質も、ライセート調製時のタンパク質抽出効率がウェスタンブロットの結果に影響を及ぼします。こうしたタンパク質を扱う場合は、SDS(ドデシル硫酸ナトリウム)のような細胞の内容物を完全にバッファーに溶解できる作用の強い界面活性剤を含有している「RIPAバッファー」を使用してサンプルを溶解することを推奨します。代替手法として、細胞内の特定の画分を抽出する分画キットを採用することも可能です。ミトコンドリア分画キットや核抽出キットを用いることで特定画分サンプルの濃縮が可能で、目的タンパク質の濃度を上げることができます。
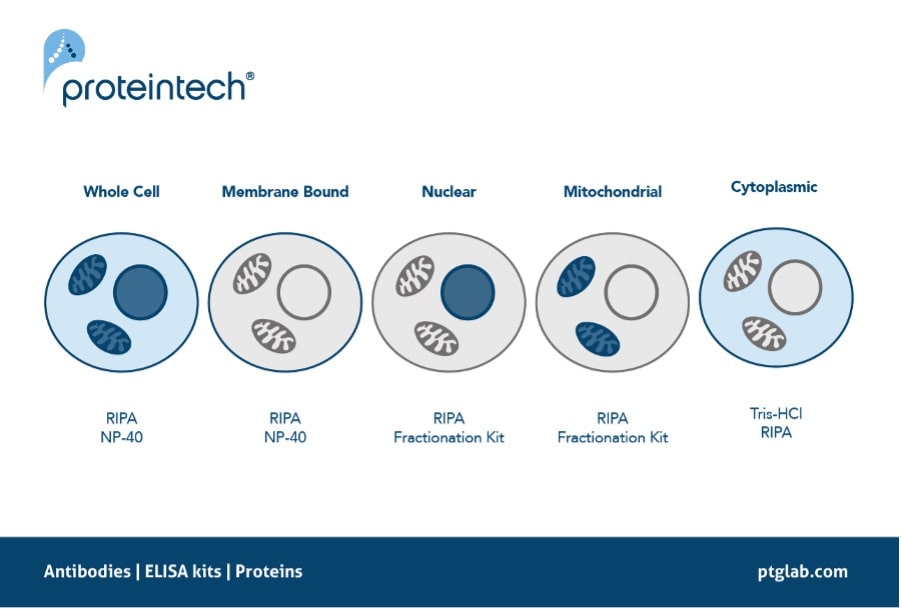
図3. 目的タンパク質の局在と推奨される抽出バッファー
最後に、抗体をプロービングする前に、SDS-PAGE後のタンパク質がメンブレンに完全に転写(トランスファー)されていることを確認することも重要なステップです。目的タンパク質の存在量が少ないと、転写段階におけるタンパク質の喪失によって目的タンパク質シグナルが全く認められなくなる可能性があります。メンブレンへの転写法には様々な方法があり、それぞれの特性や注意する点は異なります。目的タンパク質を確実に回収できるように、転写法の最適化の実施を強く推奨します。例えば、分子量が大きいタンパク質の場合は転写時間を延長し、電圧を上げます。また、PVDFの方がニトロセルロースよりも結合能が高いことからPVDFメンブレンの使用を推奨します。転写方法の改善以外にも、抗体がメンブレンへ非特異的に吸着・結合しないように処理を施すとバックグラウンドが抑えられ、目的タンパク質を検出しやすくなります。
抗体検証と考慮事項
前項までの注意点に加え、感度の高いECL基質を使用する場合は、抗体濃度の最適化がさらに重要なポイントとなります。よく誤解されていることは、一次抗体や二次抗体の抗体濃度を高くすると必ず良好なシグナルを得られるようになるという点です。この改善方法は、すべての事例にあてはまるわけではありません。高感度ECLを使用したウェスタンブロット検出の場合、二次抗体の抗体濃度が高すぎると酵素の過剰な作用を原因とするシグナルの急速なサチュレーション(飽和)によってバックグラウンドが高くなることと、シグナル自体の強度が変動しやすくなることで、再現性のある結果が得られにくくなります。高感度ECLを使用する場合は、一次抗体と二次抗体の濃度を通常よりも低くすることを推奨します。また、初期検討を実施する場合は、常に一次抗体・二次抗体のメーカー推奨濃度に従って抗体を希釈します。推奨濃度に従わずに抗体を高濃度で使用すると、メンブレン全体が真っ黒に撮像されてしまい、個別のレーンやバンドを確認することができなくなってしまいます。超高感度ECLを使用する際は、検討実験を何回か実施する必要があります。SignalBrightシリーズは、推奨濃度や推奨希釈倍率等の情報をデータシートに記載しており、実験の最適化プロセスをサポートします。
抗体を使用するすべての実験手法において、ターゲットタンパク質に対して十分に検証された抗体を用いることの重要性は明白であり、ウェスタンブロットでも例外ではありません。検証試験が実施され、信頼性のあるデータを得られることが判明している一次抗体を使用することは、存在量の少ないタンパク質について研究する際の非常に重要なポイントの1つです。遺伝子組換えによってターゲットタンパク質の発現量を操作したサンプルを用いて検証試験を実施する方法は、ターゲット特異性を担保できる最も信頼のおける方法であることから、「KD/KO試験」による検証試験済と明記された抗体を研究に使用するのが理想的です。KD/KO試験が実施された抗体は、ターゲットタンパク質の発現をノックダウン(KD)、あるいはノックアウト(KO)したサンプルを使用してウェスタンブロットを実施し、無処理のコントロールサンプルと比較して目的タンパク質のシグナルが消失していることを確認することで、抗体のターゲットタンパク質に対する特異性が保証されています。プロテインテックは、抗体メーカーの中でも最大規模のKD/KO検証済み抗体を取り揃えており、高感度ECL基質との組み合わせに最適な一連の製品群を提供します。
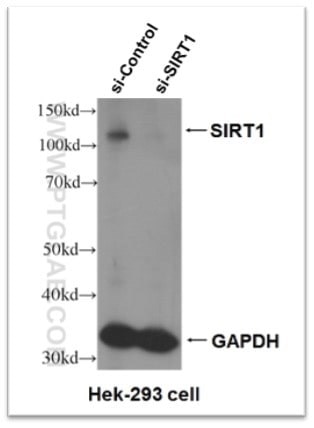
図4. SIRT1抗体(カタログ番号:13161-1-AP)のKD(Knock-down)検証試験の結果。
SIRT1遺伝子に対するsiRNA処理を施したHEK293細胞において、SIRT1のシグナルが有意に減少しています。
まとめ
存在量の少ないタンパク質は、ウェスタンブロットによって検出することが難しい場合がありますが、まったく不可能な難題というわけではありません。高感度ECL基質を用いたウェスタンブロットは、存在量の少ないタンパク質の検出可能性を高める、試してみる価値のある手法です。ウェスタンブロットで存在量の少ないタンパク質の「貴重なバンド」の検出を試みる際は、上述した複数のポイントに注意しながら適切な手順に従って実験を実施しましょう。
Kathryn Green著(ノッティンガム大学、博士課程)
関連製品
Western blot products overview
Tag & loading control antibodies
SignalBright chemiluminescent substrate
関連情報
In search of low molecular weight proteins
Loading control antibodies for Western blot
Lysate preparation: why RIPA buffer is best
Lysate preparation: how to optimize your extraction
Why does the observed protein molecular weight (MW) differ from the calculated one?
Proteases for Western blotting: Choosing the right tools for the job
Learn how to save precious hours on your IP, IF, and Western blotting experiments


