ヒントとコツ | 免疫沈降(IP)で良好な結果を得るための5つの最適化ポイント
タンパク質のプルダウンアッセイ/免疫沈降(IP:Immunoprecipitation)実験は、目的タンパク質の発現レベルが低い場合に困難を伴います。本稿では、免疫沈降の結果を改善するための5つのポイントを紹介します。
タンパク質濃度が高いほど、免疫沈降で回収できる目的タンパク質の収量は増加します。可能な限り高いタンパク質濃度を備えるサンプルを使用するようにしましょう。例えば、サンプルに含まれるターゲットタンパク質濃度が1 nM(タンパク質発現レベルが低い条件)、50 nM(内在性タンパク質の発現レベルで、免疫沈降用バッファーに溶解)、100 nM(タンパク質濃度が高い条件)の各条件で免疫沈降を実施した場合、実験結果には大きな違いが生じます。
同一のタンパク質サンプルでも、異なる解離定数(KD)を示すアフィニティ樹脂担体で免疫沈降を実施すると、得られるタンパク質収量に違いが生じます(上段:GST-Trap、下段:Glutathione樹脂)。
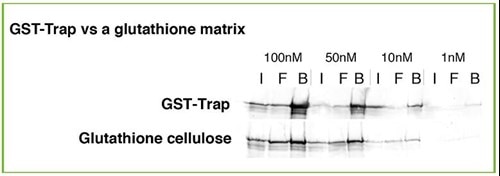
アフィニティ樹脂担体の結合親和性が高いほど、免疫沈降で回収できるタンパク質収量は増加します。
免疫沈降に用いる特異的抗体は、ターゲットタンパク質が豊富に存在する条件では良好に機能しても、タンパク質濃度が低い条件では機能しない場合があります。免疫沈降にはターゲットに対して親和性の高い抗体(KD値が小さい抗体)を使用することを推奨します。親和性の低い抗体(KD値が大きい抗体)は、サンプル中のターゲットタンパク質の濃度が低い場合、ごく限られたターゲットタンパク質としか結合できません。タンパク質濃度が50 nMの条件で免疫沈降を実施すると、親和性の低い免疫沈降ビーズ(KD=150 nM)は約25%程度のタンパク質としか結合しません。一方で、親和性の高い免疫沈降ビーズ(KD=1 nM)は約98%のタンパク質と結合することができます。つまり、免疫沈降ビーズがターゲットタンパク質に対して示す解離定数(KD)の違いによって、実験結果に決定的な差が表れます。
|
アフィニティ樹脂担体 |
解離定数 |
所定のタンパク質濃度(nM)における |
||
|
1 nM |
10 nM |
50 nM |
||
|
一般的なタンパク質精製用アフィニティ樹脂担体 |
150 nM |
<1 % |
6 % |
25 % |
|
<0.005 pmol |
0.3 pmol |
6.25 pmol |
||
|
免疫沈降用 |
1 nM |
50 % |
91 % |
98 % |
|
0.25 pmol |
4.55 pmol |
24.5 pmol |
||
プルダウンアッセイや免疫沈降実験において、アフィニティ樹脂担体により捕捉されるタンパク質の量と割合は、サンプル溶液中のタンパク質濃度およびアフィニティ樹脂担体の解離定数(KD)に依存します。表に記載した数値は、所定のタンパク質量(nM)になるよう調製した総容量500μl(サンプル溶液、バッファー、ビーズスラリーの合計)の溶液を免疫沈降に使用すると仮定して計算されました。
クロモテック(2020年よりプロテインテックの一部)のGFP-Trap®はKD=1 pMと、非常に低い解離定数で高い親和性を示し、ターゲットとなるGFP融合タンパク質濃度が非常に低いサンプルであっても、極めて効率的に免疫沈降で回収することができます。
洗浄時間が短いほど、高い収率で目的タンパク質を回収することができます。免疫沈降後のビーズ担体の最適な洗浄時間は、実験によって検討・決定しなければなりません。バックグラウンドの状態を確認して適切な洗浄時間を決定します。また、解離速度定数(Koff)の値が低いアフィニティ樹脂担体を用いると、担体に結合したターゲットタンパク質が洗浄操作中に溶失するのを抑えることができます。
アフィニティ樹脂担体の特異性が高いほど、バックグラウンドは低くなります。信頼性および再現性の高い結果を得るには、特異性の高い、十分に特性解析や検証試験が実施されたアフィニティ樹脂担体を使用します。
サンプル調製時に添加するバッファー溶液の容量が少ないほど、効率的に免疫沈降を実施することができます。サンプル調製時のバッファー容量を小さくするとタンパク質濃度を高い状態に保つことができます。そのため、抗体の結合効率が向上します。サンプル溶液中のタンパク質濃度は、サンプル調製時のバッファー容量によって変化します。免疫沈降では、できる限り容量が少ないバッファー溶液を使用します。溶液中のタンパク質濃度が高くなるようにサンプルを調製することで、ターゲットと免疫沈降ビーズの結合効率が向上し、目的タンパク質を効率的に回収することができます。
以上のように、免疫沈降で良好な結果を得るには、サンプル中の目的タンパク質濃度、アフィニティ樹脂担体の結合親和性、洗浄時間、アフィニティ樹脂担体の特異性、サンプル調製時のバッファー容量を念頭に置いて実験を計画しましょう。
プロテインテックでは、Nano-Trapのサンプルを無償で提供しています。下記フォームよりご依頼ください。
(※ 国内におけるプロテインテック製品の出荷および販売は、コスモ・バイオ株式会社を通じて行っております。
最寄りのコスモ・バイオ株式会社 代理店をご指定の上、ご依頼ください。)
本稿で紹介した内容の詳細については、ホワイトペーパー「Immunoprecipitation of proteins at very low expression levels using GST-Trap and MBP-Trap[PDF](言語:英語)」をご覧ください。
ホワイトペーパーでは、クロモテック(2020年よりプロテインテックの一部)が製造・販売する免疫沈降用ビーズである「Nano-Trap」シリーズのGST-TrapおよびMBP-Trapを用いて、その優れたパフォーマンスを実証しています。目的タンパク質の発現レベルが低いサンプルや希釈された低濃度サンプルから目的タンパク質を効率的に免疫沈降するにあたって、両製品の低い解離定数がどのように寄与するかについて、理論的枠組みを含めて解説しています。

